题目内容
1.二氧化碳作为含碳化合物燃烧的最终产物,其排放量正以每年4%的速度递增,大气中高浓度的CO2破坏了大气平衡,是造成全球气温升高、气候恶化的主要原因.随着科技进步和人类环保意识的增强,如何利用和固定CO2已经成为世界各国政府和有识之士特别关注的问题.根据反应:
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ•mol-1
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
某化学兴趣小组设想利用甲烷和二氧化碳反应制取一氧化碳和氢气,实现废气利用,变废为宝,试回答下列问题:
(1)写出该反应的热化学方程式CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1.
(2)已知:①体系自由能变化△G<0时,反应自发进行;△G>0时,反应不自发进行;②△G=△H-T△S;③高温下该反应的△S=0.257kJ•mol-1•K-1.若不考虑条件变化对焓变、熵变的影响,据此可初步判断反应进行的最低温度应大于926.6KK.
(3)该反应为可逆反应,其平衡常数表达式K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$;为提高该反应的速度,需选择合适的催化剂,根据中学化学催化剂的实际应用经验,兴趣小组将选择的重点范围确定为过渡(填“主族”或“过渡”)元素的单质或氧化物.由于该反应需在较高温度下才能发生,对催化剂的选择探究增加了困难.某同学认为,该反应的逆反应在常温时能自发进行(△G<0),可在常温下对逆反应进行催化剂的选择探究,然后再对该催化剂的催化效率受温度的影响进行探究.一种对逆反应有效的催化剂,对正反应也一定有效,其理由是催化剂不影响化学平衡移动,说明催化剂同等程度改变正反应速率、逆反应速率.
(4)碳酸盐是人工固定二氧化碳仅次于尿素的第二大产品,用途广泛,一种熔融碳酸盐燃料电池用Li2CO3和K2CO3的熔融盐混合物作电解质,由外部向一电极供给燃料气体(如H2或CO等),向另一电极供给空气和CO2的混合气体,写出正极的电极反应式2CO2+O2+4e-=2CO32-.
(5)自然界固定二氧化碳的主要方式是绿色植物的光合作用.生物学家曾经认为地球上的生态系统离不开阳光,但在11000m漆黑的深海底发现了无脊椎动物.这些生物完全依靠化学自养菌,以海底热泉喷出液中的硫化物如H2S为能源,利用CO2合成(C6H10O3)n和一种淡黄色固体,写出该反应的化学方程式6n CO2+12n H2S=(C6H10O3)n+12n S↓+7n H2O.
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
(2)△G=△H-T△S<0时,反应自发进行;
(3)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
一般在过渡元素中需找合适的催化剂;
催化剂不影响化学平衡移动,说明催化剂同等程度改变正逆反应速率;
(4)原电池正极发生还原反应,二氧化碳与氧气在正极通入,氧气获得电子生成碳酸根离子;
(5)由题目信息可知,二氧化碳与硫化氢反应得到(C6H10O3)n和淡黄色固体S,由C、O比例关系可知应有水生成,配平书写方程式.
解答 解:(1)已知:①.CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ•mol-1
②.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
根据盖斯定律,②-①可得:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1,
故答案为:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1;
(2)反应的△H=+247.4kJ•mol-1,△S=0.257kJ•mol-1•K-1,△G=△H-T△S<0时,反应自发进行,故247.4kJ•mol-1-T×0.257kJ•mol-1•K-1<0,解得T>926.6K,
故答案为:926.6K;
(3)反应CH4(g)+CO2(g)?2CO(g)+2H2(g)的平衡常数K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$;一般在过渡元素中需找合适的催化剂;催化剂不影响化学平衡移动,说明催化剂同等程度改变正反应速率、逆反应速率,
故答案为:$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$;过渡;催化剂不影响化学平衡移动,说明催化剂同等程度改变正反应速率、逆反应速率;
(4)原电池正极发生还原反应,二氧化碳与氧气在正极通入,氧气获得电子生成碳酸根离子,电极反应式为:2CO2+O2+4e-=2CO32-,
故答案为:2CO2+O2+4e-=2CO32-;
(5)由题目信息可知,二氧化碳与硫化氢反应得到(C6H10O3)n和淡黄色固体S,由C、O比例关系可知应有水生成,该反应方程式为:6n CO2+12n H2S=(C6H10O3)n+12n S↓+7n H2O,
故答案为:6n CO2+12n H2S=(C6H10O3)n+12n S↓+7n H2O.
点评 本题属于拼合型题目,涉及热化学方程式书写、反应自发性问题、平衡常数、催化剂对反应速率与化学平衡乙烯、原电池、化学方程式书写等,需要学生具备扎实的基础,难度中等.

| A. | 煤的干馏、石油的分馏都只发生了物理变化 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成了CO2和H2O | |
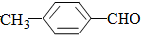
| C. | 甲烷和苯都能发生取代反应 | |
| D. | 乙醇和乙酸互为同分异构体 |
| A. | NH4Cl加热分解只生成HCl和NH3,NH4I固体加热分解也只生成HI和NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 足量的CO2气体通入Na2SiO3中可生成NaHCO3; 足量的CO2气体通入石炭酸中也生成了NaHCO3 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
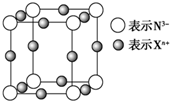
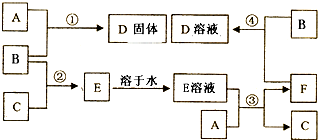
 、⑤ClCH=CHCl⑥
、⑤ClCH=CHCl⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨
、⑨

 (或
(或 )
)

 溶解性由大到小的顺序
溶解性由大到小的顺序