��Ŀ����
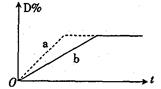
ij�ܱ������д���2NO+O2 2NO2��Ӧ��ƽ��ʱNO��ת�������¶ȱ仯��ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ����
2NO2��Ӧ��ƽ��ʱNO��ת�������¶ȱ仯��ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ����
 2NO2��Ӧ��ƽ��ʱNO��ת�������¶ȱ仯��ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ����
2NO2��Ӧ��ƽ��ʱNO��ת�������¶ȱ仯��ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ����
| A���÷�Ӧ������Ӧ�����ȷ�Ӧ |
| B�����¶�ΪT1��T3ʱ��ƽ�ⳣ���ֱ�ΪK1��K3����K1��K3 |
| C��T1ʱ������Ӧ����D�㣬��÷�Ӧ���淴Ӧ���ʴ�������Ӧ���� |
| D�������С�����������ƽ��ʱ��ʾNOת�������¶ȱ仯��ϵ��������ԭ�����Ϸ� |
D
���������A������ͼ���֪�������¶ȵ����ߣ�NO��ת�������͡���˵�������¶�ƽ�����淴Ӧ������У��������Ӧ�Ƿ��ȷ�Ӧ��A����ȷ��B�������¶�ƽ�����淴Ӧ������У�ƽ�ⳣ�����ͣ�������¶�ΪT1��T3ʱ��ƽ�ⳣ���ֱ�ΪK1��K3����K1��K3��B����ȷ��C��T1ʱ������Ӧ����D��ʱ��Ҫ��ﵽƽ��״̬�������¶Ȳ��������£�NO��ת����������˵����Ӧ������Ӧ������У���÷�Ӧ���淴Ӧ����С������Ӧ���ʣ�C����ȷ��D�������С���������ѹǿ����ƽ��������Ӧ������У�NO��ת����������ƽ��ʱ��ʾNOת�������¶ȱ仯��ϵ��������ԭ�����Ϸ���D��ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ
 aZ(g) ��H=QkJ��mol-1����ʼ�������2:1��X��Y���뷴Ӧ���У�һ�������·�����Ӧ��ͼ��ͼ���Ǹ��ݷ�Ӧ���Ƶ�ͼ�������й�˵����ȷ����
aZ(g) ��H=QkJ��mol-1����ʼ�������2:1��X��Y���뷴Ӧ���У�һ�������·�����Ӧ��ͼ��ͼ���Ǹ��ݷ�Ӧ���Ƶ�ͼ�������й�˵����ȷ����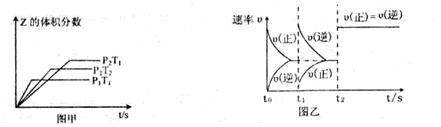
 2C(g) ��H<0��2 min��Ӧ�ﵽƽ�⣬����CΪ1��6 mol�������з�����ȷ���� �� ��
2C(g) ��H<0��2 min��Ӧ�ﵽƽ�⣬����CΪ1��6 mol�������з�����ȷ���� �� �� NH3(g) + HI(g)
NH3(g) + HI(g)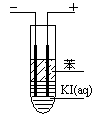
 CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ� ��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0)
��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0) 2NH3(g) ��H=��94.4kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ��
2NH3(g) ��H=��94.4kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ��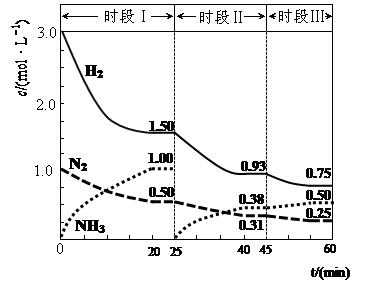
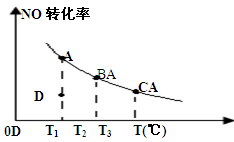
 5N2O(g)+3H2O(g) ��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ����ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������ ���������ֹ��ɵ�ԭ���� ���δ������һ��ԭ��
5N2O(g)+3H2O(g) ��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ����ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������ ���������ֹ��ɵ�ԭ���� ���δ������һ��ԭ��
 2C��g������2 s ����C��Ũ��Ϊ0.6 mol/L�����м���˵����ȷ���ǣ���������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol/��L��s������������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol/��L��s�����۷�Ӧ�ﵽƽ��ʱ��A��B��C�ķ�Ӧ����һ����ȣ��ܷ�Ӧ�ﵽƽ��ʱ��A��B��C�����ʵ��������ٱ仯
2C��g������2 s ����C��Ũ��Ϊ0.6 mol/L�����м���˵����ȷ���ǣ���������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol/��L��s������������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol/��L��s�����۷�Ӧ�ﵽƽ��ʱ��A��B��C�ķ�Ӧ����һ����ȣ��ܷ�Ӧ�ﵽƽ��ʱ��A��B��C�����ʵ��������ٱ仯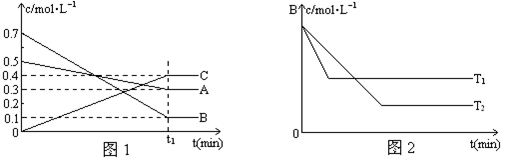
 2C(g)+2D(g) ��H��0����ͼ������a��b�ֱ��ʾ�ڲ�ͬ�����£�A��B��Ӧʱ��D�����������ʱ��t�ı仯���������ʹ����b(ʵ�ߣ���Ϊ����a(���ߣ����ɲ��õĴ�
2C(g)+2D(g) ��H��0����ͼ������a��b�ֱ��ʾ�ڲ�ͬ�����£�A��B��Ӧʱ��D�����������ʱ��t�ı仯���������ʹ����b(ʵ�ߣ���Ϊ����a(���ߣ����ɲ��õĴ�