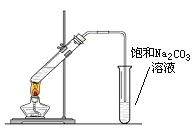
题目内容
【题目】氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下
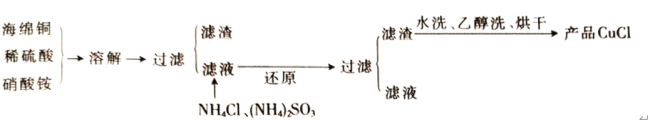
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:_________
Cu+ NO3-+ = Cu2++ NO↑+ H2O
(2)“还原”过程中,作还原剂的是__________(填化学式);写出“还原”过程中发生反应的离子方程式:__________________________________。
(3)写出CuCl在潮湿的空气中被氧化的化学方程式:__________________________。
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是_____________________________。
【答案】3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O (NH4)2SO3 2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+ 4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl 防止CuCl在潮湿空气中被氧化
【解析】
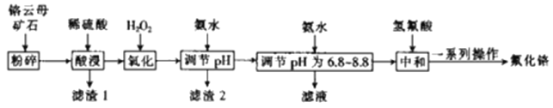
由流程可知,海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜、加入氯化铵氯化发生反应2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸,CuCl水洗、乙醇洗后烘干得到产品CuCl,以此来解答。
(1)溶解过程中铜和硝酸根离子发生氧化还原反应,离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
(2)还原步骤发生反应的离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,S元素的化合价升高,还原剂为(NH4)2SO3,
故答案为:(NH4)2SO3;2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+;
(3)氯化亚铜在空气中被氧化的化学方程式为4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl,
故答案为:4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl;
(4)70℃真空干燥加快乙醇和水的挥发,密封包装的原因是防止CuCl在潮湿空气中被氧化,
故答案为:防止CuCl在潮湿空气中被氧化。

【题目】如图为碳元素的价类二维图,结合图中的物质部分转化关系,完成下列问题:
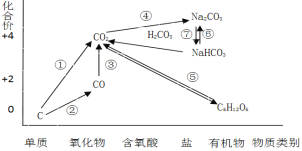
(1)下列说法正确的是 __________
a.要实现反应①一定要与氧化剂作用
b.要实现反应②一定要与还原剂作用
c.在一定条件下木炭与浓硝酸能实现 反应①转化
d.反应⑤属于非氧化还原反应
(2)下列有关碳及其化合物类别及性质说法不正确的是__________
a.CO不属于酸性氧化物,具有还原性
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应又能与NaOH反应
d.金刚石和石墨互为同素异形体,其物理性质和化学性质均相同
(3)高炉炼铁的过程是将铁矿石(Fe2O3)还原成金属铁的过程,实现了反应③的转化,请写出其反应的化学方程式,并用“双线桥”表示电子的得失情况______________________________ 。
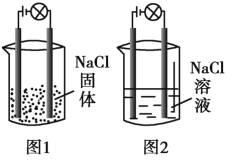
(4)化学活动课上,两组同学分别用如图所示甲、乙两装置探究“Na2CO3、NaHCO3与稀盐酸的反应”。按下表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。请回答:
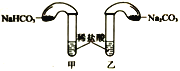
①两组反应开始时,装置___________(填“甲”或“乙”)中的气球体积先变大,该装置中反应的离子方程式是______________________。
②当试管中不再有气体生成时,两组实验出现不同现象。
试剂用量 | 实验现象 | 分析原因 | |
第A组 | 0.84gNaHCO3 1.06gNa2CO3 6ml 4mol·L-1盐酸 | 甲中气球与乙中气球的 体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V(CO2)甲=V(CO2)乙 |
第B组 | 1.2gNaHCO3 1.2gNa2CO3 6ml 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
|
按上表第A组原因分析方法,分析第B组实验甲中气球为比乙中气球体积大的原因__________。用离子方程式表示第B组乙中气球又缩小的原因:______________。