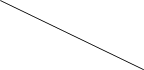
题目内容
【题目】如图为碳元素的价类二维图,结合图中的物质部分转化关系,完成下列问题:
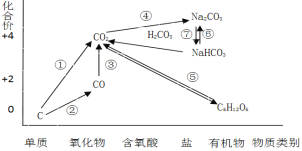
(1)下列说法正确的是 __________
a.要实现反应①一定要与氧化剂作用
b.要实现反应②一定要与还原剂作用
c.在一定条件下木炭与浓硝酸能实现 反应①转化
d.反应⑤属于非氧化还原反应
(2)下列有关碳及其化合物类别及性质说法不正确的是__________
a.CO不属于酸性氧化物,具有还原性
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应又能与NaOH反应
d.金刚石和石墨互为同素异形体,其物理性质和化学性质均相同
(3)高炉炼铁的过程是将铁矿石(Fe2O3)还原成金属铁的过程,实现了反应③的转化,请写出其反应的化学方程式,并用“双线桥”表示电子的得失情况______________________________ 。
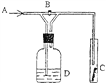
(4)化学活动课上,两组同学分别用如图所示甲、乙两装置探究“Na2CO3、NaHCO3与稀盐酸的反应”。按下表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。请回答:
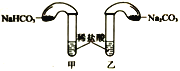
①两组反应开始时,装置___________(填“甲”或“乙”)中的气球体积先变大,该装置中反应的离子方程式是______________________。
②当试管中不再有气体生成时,两组实验出现不同现象。
试剂用量 | 实验现象 | 分析原因 | |
第A组 | 0.84gNaHCO3 1.06gNa2CO3 6ml 4mol·L-1盐酸 | 甲中气球与乙中气球的 体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V(CO2)甲=V(CO2)乙 |
第B组 | 1.2gNaHCO3 1.2gNa2CO3 6ml 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
|
按上表第A组原因分析方法,分析第B组实验甲中气球为比乙中气球体积大的原因__________。用离子方程式表示第B组乙中气球又缩小的原因:______________。
【答案】A C D  甲 H++HCO3-=CO2↑+H2O 甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3) ,V(CO2)甲﹥V(CO2)乙 CO32-+CO2+H2O=2HCO3-
甲 H++HCO3-=CO2↑+H2O 甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3) ,V(CO2)甲﹥V(CO2)乙 CO32-+CO2+H2O=2HCO3-
【解析】
(1)根据氧化还原反应的有关规律判断;
(2)a. CO不属于酸性氧化物,C元素化合价为+2价,具有还原性,故a正确;
b. CO2属于酸性氧化物,可以与碱反应生成碳酸盐,故b正确;
c. NaHCO3属于弱酸的酸式盐,既能与硫酸反应生成二氧化碳和水,又能与NaOH反应生成碳酸钠,故c正确;
d. 金刚石和石墨互为同素异形体,其化学性质相似,物理性质有很大差异,故d错误;
(3)Fe2O3在高温下可以被CO还原成Fe单质,Fe元素由+3价下降到0价,得到3个电子;
(4)①碳酸氢钠和盐酸反应的速率更快;
②按上表第A组原因分析方法,分析第B组实验中反应物之间的数量关系,二氧化碳可以溶于碳酸钠溶液中。
(1)a.①C ![]() CO2,C化合价升高作为还原剂,需要加入氧化剂才能实现,故a正确;
CO2,C化合价升高作为还原剂,需要加入氧化剂才能实现,故a正确;
b.①C ![]() CO,C化合价升高作为还原剂,需要加入氧化剂才能实现,故b错误;
CO,C化合价升高作为还原剂,需要加入氧化剂才能实现,故b错误;
c.木炭与浓硝酸在加热的条件下可以生成二氧化碳,可以实现反应①转化,故c正确;
d. 反应⑤中C化合价变化,属于氧化还原反应,故d错误;
正确答案是ac;
(2)a. CO不属于酸性氧化物,C元素化合价为+2价,具有还原性,故a正确;
b. CO2属于酸性氧化物,可以与碱反应生成碳酸盐,故b正确;
c. NaHCO3属于弱酸的酸式盐,既能与硫酸反应生成二氧化碳和水,又能与NaOH反应生成碳酸钠,故c正确;
d. 金刚石和石墨互为同素异形体,其化学性质相似,物理性质有很大差异,故d错误;
题目要求选错的,故选d;
(3)Fe2O3在高温下可以被CO还原成Fe单质,Fe元素由+3价下降到0价,得到3个电子,用“双线桥”表示电子的得失情况为:
(4)①碳酸钠和盐酸的反应可以分成两步:第一步Na2CO3+HCl=NaHCO3+NaCl,第二步 NaHCO3+HCl=NaCl+H2O+CO2![]() ,而碳酸氢钠只进行第二步反应,所以更快一些,故装置甲中的气球体积先变大,甲中发生的离子方程式是:H++HCO3-=CO2↑+H2O;
,而碳酸氢钠只进行第二步反应,所以更快一些,故装置甲中的气球体积先变大,甲中发生的离子方程式是:H++HCO3-=CO2↑+H2O;
②根据化学方程式计算可知A组中NaHCO3和Na2CO3都已完全反应。B组中,n(Na2CO3)= ![]() =0.011mol,n(NaHCO3)=
=0.011mol,n(NaHCO3)= ![]() =0.014mol,n(HCl)=0.012mol,根据反应NaHCO3+HCl =NaCl + CO2↑+H2O和Na2CO3+2HCl=2NaCl+CO2↑+H2O可知,Na2CO3、NaHCO3都过量,NaHCO3产生的CO2较Na2CO3的多。因为气体收集于气球中,乙中CO2又与过量的Na2CO3溶液反应,故甲中气球比乙中气球的体积大片刻后,乙中气球又缩小,甲中气球的体积基本不变,分析原因为:甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3) ,V(CO2)甲﹥V(CO2)乙;CO2与过量的Na2CO3溶液反应为:CO32-+CO2+H2O=2HCO3-。
=0.014mol,n(HCl)=0.012mol,根据反应NaHCO3+HCl =NaCl + CO2↑+H2O和Na2CO3+2HCl=2NaCl+CO2↑+H2O可知,Na2CO3、NaHCO3都过量,NaHCO3产生的CO2较Na2CO3的多。因为气体收集于气球中,乙中CO2又与过量的Na2CO3溶液反应,故甲中气球比乙中气球的体积大片刻后,乙中气球又缩小,甲中气球的体积基本不变,分析原因为:甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3) ,V(CO2)甲﹥V(CO2)乙;CO2与过量的Na2CO3溶液反应为:CO32-+CO2+H2O=2HCO3-。

【题目】已知常温下浓度为0.1mol·L-1的下列溶液的pH如下表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol·L-1
C. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
D. 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-)
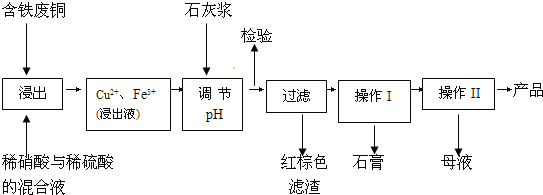
【题目】硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO45H2O)和副产物石膏(CaSO42H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是___;
(2)写出浸出过程中生成硫酸铜的离子方程式___;
(3)操作I包括蒸发浓缩、__等操作,温度应该控制在__℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为__、___、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__;干燥时采用晾干,不用加热烘干的原因是___。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是__;
②指出你认为不合理方案存在的问题是__。