题目内容
【题目】已知25 ℃时,醋酸溶液中存在下述关系:Ka=c(H+)c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中Ka的数值是该温度下醋酸的电离平衡常数。有关Ka的下列说法正确的是( )
A. 当向该溶液中加入一定量的硫酸时,Ka的值增大
B. 升高温度,Ka的值增大
C. 向醋酸溶液中加水,Ka的值增大
D. 向醋酸溶液中加氢氧化钠溶液,Ka的值增大
【答案】B
【解析】
醋酸溶液中存在CH3COOH ![]() H++CH3COO-, Ka=c(H+)c(CH3COO-)/c(CH3COOH),根据Ka的表达式和影响因素分析解答。
H++CH3COO-, Ka=c(H+)c(CH3COO-)/c(CH3COOH),根据Ka的表达式和影响因素分析解答。
A. 向醋酸溶液中加入一定量的硫酸时,c(H+)增大,CH3COOH ![]() H++CH3COO-平衡逆向移动,但温度不变,Ka不变,故A错误;
H++CH3COO-平衡逆向移动,但温度不变,Ka不变,故A错误;
B. 醋酸的电离为吸热过程,升高温度,促进电离,Ka的值增大,故B正确;
C. 向醋酸溶液中加水,促进醋酸的电离,但温度不变,Ka不变,故C错误;
D. 向醋酸溶液中加氢氧化钠溶液,c(H+)减小,CH3COOH ![]() H++CH3COO-平衡正向移动,但温度不变,Ka不变,故D错误;
H++CH3COO-平衡正向移动,但温度不变,Ka不变,故D错误;
故选B。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】氮的化合物在工农业生产及航天航空业中具有广泛的用途。回答下列问题:
⑴NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为______,NF3在空气中泄漏时很容易被观察到,原因是_______。
⑵汽车尾气中催化剂可将NO、CO转化成无害气体。
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能/kJ·mol1 | 1076 | 630 | 945 | 803 |
2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH
①ΔH=______________________________kJ·mol1。
②该反应的平衡常数与外界因素X(代表温度、压强、![]() 或催化剂接触面)关系如下图所示。
或催化剂接触面)关系如下图所示。
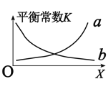
X是______,能正确表达平衡常数K随X变化的曲线是_______(填:a或b)。
⑶在一定温度和催化剂作用下,8NH3(g)+8NO(g)+2NO2(g)9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1。
①n=_____;
②υ(NO)=______;
③NH3的平衡转化率为_________。
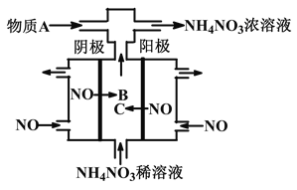
⑷用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将____________(填:增大、减小或不变)。阳极的电极反应式为______________。