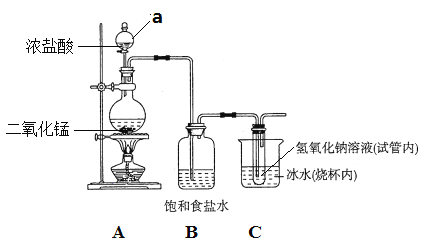
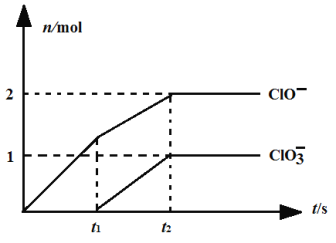
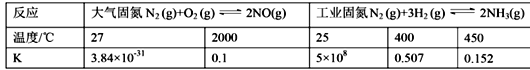
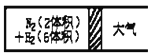
题目内容
【题目】将11.2g铁粉投入200mL的稀硫酸中,充分反应后,铁粉完全溶解。(假设反应后溶液体积不发生变化,写出计算过程)
⑴求标准状况下产生气体的体积。(已知:Fe+H2SO4=FeSO4+H2↑)_____________
⑵求反应后溶液中FeSO4的物质的量浓度。_________________
【答案】4.48L c(FeSO4)=1.00mol·L-1
【解析】
本题是一道考察物质的量综合运用的题目,综合性较强,但难度一般,同学们可以借这道题来对物质的量进行综合的复习。
(1)先根据![]() 算出铁的物质的量,根据方程式
算出铁的物质的量,根据方程式![]() 看出铁和氢气的物质的量为1:1,因此产生氢气的物质的量也为0.2mol,再根据
看出铁和氢气的物质的量为1:1,因此产生氢气的物质的量也为0.2mol,再根据![]() 即可;
即可;
(2)根据第一问可知产生的![]() 的物质的量也为0.2mol,根据
的物质的量也为0.2mol,根据![]() 算出溶液的浓度即可。
算出溶液的浓度即可。

练习册系列答案
相关题目