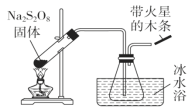
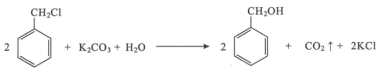
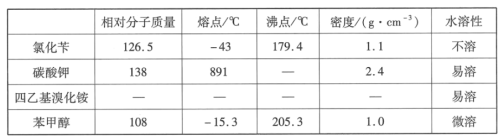
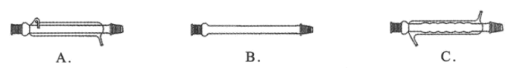题目内容
【题目】氮的化合物在工农业生产及航天航空业中具有广泛的用途。回答下列问题:
⑴NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为______,NF3在空气中泄漏时很容易被观察到,原因是_______。
⑵汽车尾气中催化剂可将NO、CO转化成无害气体。
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能/kJ·mol1 | 1076 | 630 | 945 | 803 |
2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH
①ΔH=______________________________kJ·mol1。
②该反应的平衡常数与外界因素X(代表温度、压强、![]() 或催化剂接触面)关系如下图所示。
或催化剂接触面)关系如下图所示。
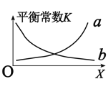
X是______,能正确表达平衡常数K随X变化的曲线是_______(填:a或b)。
⑶在一定温度和催化剂作用下,8NH3(g)+8NO(g)+2NO2(g)9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1。
①n=_____;
②υ(NO)=______;
③NH3的平衡转化率为_________。
⑷用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将____________(填:增大、减小或不变)。阳极的电极反应式为______________。

【答案】2:1 NO与O2反应生成红棕色NO2 -745 温度 b 1.25 0.15mol·L1·min1 75% 增大 2CN--10e-+12OH-=2CO32-+N2↑+6H2O
【解析】
(1)NF3在潮湿的环境中易变质生成HF、NO、HNO3,该反应的方程式为3NF3+5H2O=2NO+HNO3+9HF,其中NO是还原产物,硝酸是氧化产物,则氧化剂与还原剂的物质的量之比为2:1。由于生成的NO与O2反应生成红棕色的NO2,所以NF3在空气中泄漏时很容易被观察到,故答案为:2:1;NO与O2反应生成红棕色的NO2;
(2)①结合图表中的数据,根据ΔH=反应物的总键能-生成物的总键能可得,ΔH=(630×2+1076×2-945-803×4)kJ·mol-1=-745 kJ·mol-1,故答案为:-745;
②平衡常数K只与温度有关,则X代表温度,由(1)可知,该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故曲线b符合平衡常数随温度的变化,故答案为:温度;b;
(3)由题干信息,设NH3转化的物质的量浓度为8xmol/L,列三段式有:
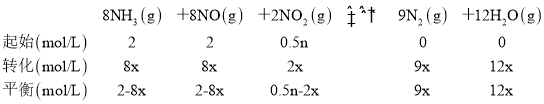
①已知经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1,则2-8x=0.5,解得8x=1.5,则0.5n-2x=0.5n-0.375=0.25,解得n=1.25,故答案为:1.25;
②![]() ,故答案为:0.15mol·L1·min1;
,故答案为:0.15mol·L1·min1;
③NH3的平衡转化率![]() ,故答案为:75%;
,故答案为:75%;
(4)用电解法将工业废水中的CN-转变为N2,氮元素化合价从-3价升高到0价,碳元素化合价从+2价升高到+4价,发生氧化反应,所以装置左侧为阳极,右侧为阴极,根据电解原理可知,H+在阴极得电子发生还原反应,电极反应式为:2H2O+2e-===H2↑+2OH-,阴极有OH-生成,所以pH增大,在阳极,CN-将转变为N2和CO32-,氮元素化合价从-3价升高到0价,碳元素化合价从+2价升高到+4价,电极反应式为:2CN--10e-+12OH-===2CO32-+N2↑+6H2O,故答案为:增大;2CN--10e-+12OH-===2CO32-+N2↑+6H2O。

【题目】下图是一检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y(足量)可能是( )
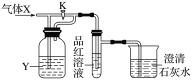
选项 | A | B | C | D |
X | CO | SO2 | CO2 | Cl2 |
Y | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D