题目内容
13.元素周期表中某区域的一些元素可用于制造耐高温耐腐蚀合金材料,它们是( )| A. | 左下方区域的金属元素 | B. | 金属和非金属分界线附近的元素 | ||
| C. | 过渡元素 | D. | 稀有气体元素 |
分析 元素周期表中位置相近的元素性质相似,因此人们可以在元素周期表中一定的区域内研究合成有特定性质的新物质.如在金属和非金属的分界线附近寻找半导体材料(如锗、硅、硒等),在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素).
解答 解:优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素)大多属于过渡元素,故选C.
点评 本题考查元素的性质、位置以及用途,题目难度不大,属于周期表的应用问题,注意把握周期表中元素的排列规律.

练习册系列答案
相关题目
19.下列各组化合物中,化学键类型完全相同的是( )
| A. | Na2O 和Na2O2 | B. | CaCl2 和 Na2S | C. | CO2 和 CaO | D. | HCl 和NaOH |
4.下列化学用语正确的是( )
| A. | 醛基的结构简式-COH | B. | 丙烯分子的结构简式为:CH3CHCH2 | ||
| C. | 四氯化碳分子的电子式为: | D. | 2-乙基-1,3-丁二烯的键线式: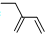 |
8.如表是部分短周期元素的原子半径及主要化合价,根据表中信息,以下叙述中,正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | B与E形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 原子的失电子能力:C>A | |
| D. | 单质与浓度相等的稀盐酸反应的速率为B>A |
18.某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
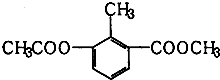

| A. | 一个分子中含有12个H原子 | B. | 该物质属于芳香族化合物 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 苯环上的一氯代物有2种 |
5.下列化合物中只存在离子键的是( )
| A. | NH3 | B. | CaCl2 | C. | H2SO4 | D. | Na2O2 |
3.下列反应中,不属于加成反应的是( )
| A. | 乙炔与氯化氢反应制取氯乙烯 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 乙醛与氢气反应生成乙醇 | D. | 苯与液溴在铁催化作用下反应 |
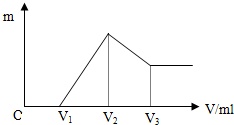 将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.
将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.

 .
. .
. .
.