题目内容
【题目】下列说正确的是( )
A.物质的量就是1摩尔物质的质量
B.1 mol水中含有2 mol氢和1 mol氧
C.1 molH2中含有6.02个氢分子
D.CO2的摩尔质量是44 g/mol
【答案】D
【解析】
试题分析:A.物质的量的单位中g/mol,质量的单位是g,故A错误;B.1 mol水中含有2 mol氢原子和1 mol氧原子,故B错误;C.1 molH2中含有6.02×1023个氢分子,故C错误;D.CO2的摩尔质量是44 g/mol,正确;故选D。

【题目】中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。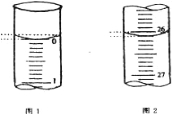
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
【题目】氮的氧化物处理和利用是环境科学研究的热点。
Ⅰ.碱吸法。用烧碱溶液吸收NO、NO2制备亚硝酸盐:2NaOH+NO2+NO=2NaNO2+H2O,2NO2+2NaOH= NaNO3+NaNO2+H2O。已知:298K时,Ka(HNO2)=5×10-4。
(1)298K时,NaNO2的水解常数约为______________。
Ⅱ.电解法。工业上以石墨为电极,用硝酸铵稀溶液作电解质溶液电解NO获得氮肥(在电解后溶液中通入适量氨气),其原理为8NO+7H2O+2NH3![]() 5NH4NO3。
5NH4NO3。
(2)阴极的电极反应式为_______________。
(3)阳极区电解质溶液的pH________(填“增大”“减小”或“不变”)。
Ⅲ.化合法。亚硝酸酰氯(NOCl)是有机合成中的重要试剂,可用NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2NOCl(g)。
2NOCl(g)。
(4)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
△H1、△H2、△H3之间的关系为_____________;K3=________(用含K1、K2的关系式表示)。
(5)在2L恒容容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(NOCl)与时间(t)的关系如图所示。
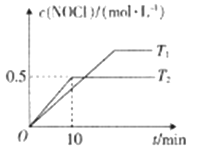
①T2时反应0~10min内NOCl的平均反应速率v(NOCl)=______mol·L-1·min-1。
②T2时反应的平衡常数K为__________;NO的平衡转化率α(NO)为_________。
③T2时向上述平衡体系中再加入1molNO(g)、1molCl2(g)、2molNOCl(g),则平衡______(填“向左”“向右”或“不”)移动。
(6)在密闭容器中充入NO(g)和Cl2(g),改变外界条件,Cl2的转化率变化如图所示。则该条件可能为____(填字母)。
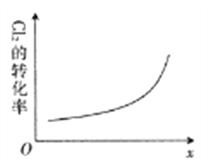
A.升高温度 B.增大压强 C.增大起始投料比![]() D.增大催化剂接触面
D.增大催化剂接触面