题目内容
【题目】五味子丙素是我国首创的高效低毒的抗肝炎新药。联苯双酯是合成五味子丙素的中间体,其生产路线如下:
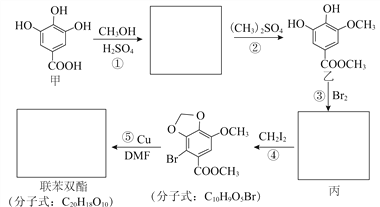
已知:卤代烃可以发生如右反应 R-X + R′-X→R-R′+ X2
回答下列问题:
(1)甲中的官能团名称为__________;反应①的反应类型为_____________。
(2)反应③除生成丙外,还生成等物质的量的HBr,反应④的化学方程式为_________。
(3)联苯双酯的结构简式为______________。
(4)乙有多种同分异构体,同时符合下列条件的有______种,请写出其中一种的结构简式_______。
a.苯环上有4个取代基,其中一个是 –OCH3;
b.与FeCl3溶液发生显色反应;
c.核磁共振氢谱为4组峰,且峰面积之比为2∶2∶3∶3。
(5)参照上述合成路线及信息,以氯气、苯和氯乙烯为原料(其它试剂任选),设计制备聚苯乙烯的合成路线__________。
【答案】 (酚)羟基,羧基 取代反应(酯化反应)  +CH2I2→
+CH2I2→ + 2HI
+ 2HI 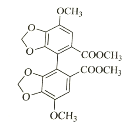 4
4 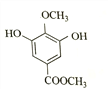 或
或 或
或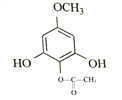 或
或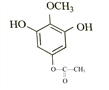
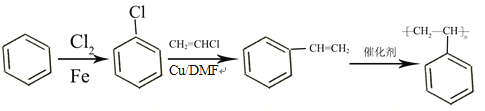
【解析】由已知结合流程可得,甲. 与CH3OH发生①酯化反应(取代反应),生成
与CH3OH发生①酯化反应(取代反应),生成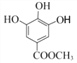 ;
; 与(CH3)2SO4发生②取代反应,生成乙.
与(CH3)2SO4发生②取代反应,生成乙.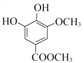 ;
; 与Br2发生③取代反应,生成丙.
与Br2发生③取代反应,生成丙. ;
; 与CH2I2发生④取代反应,生成
与CH2I2发生④取代反应,生成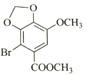 ;两分子
;两分子 发生⑤取代反应,生成联苯双酯.
发生⑤取代反应,生成联苯双酯.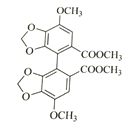 。
。
(1)甲为 ,含有羧基和(酚)羟基;由乙的结构简式
,含有羧基和(酚)羟基;由乙的结构简式 可得,
可得, 与CH3OH发生①酯化反应(取代反应),生成
与CH3OH发生①酯化反应(取代反应),生成 。
。
(2)因为反应③除生成丙外,还生成等物质的量的HBr,所以 与Br2发生③取代反应,生成丙.
与Br2发生③取代反应,生成丙. ;
; 与CH2I2发生④取代反应,生成
与CH2I2发生④取代反应,生成 ,化学方程式为:
,化学方程式为: +CH2I2→
+CH2I2→ +2HI。
+2HI。
(3)已知卤代烃可以发生反应:R-X+R′-X→R-R′+X2,所以两分子 发生⑤取代反应,生成联苯双酯.
发生⑤取代反应,生成联苯双酯. 。
。
(4)乙为 ,其同分异构体:“a.苯环上有4个取代基,其中一个是–OCH3”,–OCH3中有1种氢原子;“b.与FeCl3溶液发生显色反应”,则必有酚羟基;“c.核磁共振氢谱为4组峰,且峰面积之比为2∶2∶3∶3”,则还有两个取代基(其中一个为酚羟基,另一个为–OOCH3或–COOCH3),且苯环上有2个H,必等效。综上,符合条件的结构简式为:
,其同分异构体:“a.苯环上有4个取代基,其中一个是–OCH3”,–OCH3中有1种氢原子;“b.与FeCl3溶液发生显色反应”,则必有酚羟基;“c.核磁共振氢谱为4组峰,且峰面积之比为2∶2∶3∶3”,则还有两个取代基(其中一个为酚羟基,另一个为–OOCH3或–COOCH3),且苯环上有2个H,必等效。综上,符合条件的结构简式为: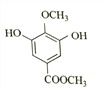 、
、 、
、 、
、 共4种。
共4种。
(5)已知卤代烃可以发生反应:R-X+R′-X→R-R′+X2,所以以氯气、苯和氯乙烯为原料制备聚苯乙烯,首先苯和氯气取代生成![]() ,然后
,然后![]() 与氯乙烯取代生成苯乙烯,最后苯乙烯发生加聚反应生成聚苯乙烯。合成路线如下:
与氯乙烯取代生成苯乙烯,最后苯乙烯发生加聚反应生成聚苯乙烯。合成路线如下: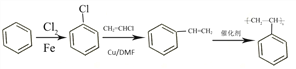 。
。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(mol·L-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________(只要求写表达式,不需计算)mol·L-1。
(2)配制过程中,下列操作配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
【题目】电离平衡是溶液化学中的重要内容,某化学兴趣小组拟以乙酸为例探究弱酸的性质。
(1)实验一:氢氧化钠标准溶液的配制。
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和______,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏_(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数。设计实验方案,将待测物理量和对应的测定方法填写在下表中。
待测物理量 | 测定方法 |
①_______ | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据。重复滴定2次。 |
②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用______测定溶液pH。 |
③ 上述实验中,如果在某温度时测得乙酸溶液的物质的量浓度为0.1000mol/L,pH=3,则在该温度时乙酸的电离平衡常数为____________。
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响。
① 设计实验方案如下表,表中c=_______g。
编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
l | 乙酸 | 0.5 | 17.0 | 2.0 |
2 | 盐酸 | 0.5 | 17.0 | c |
② 实验步骤:
a)下图的装置中,在添加药品之前必须________;
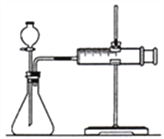
b)反应开始后,__________;
c)将所记录的欲据绘制成曲线图(下图)。

③ 写出镁与乙酸溶液反应的离子方程式:_______________。
④ 描述O~5min盐酸与镁条反应的反应速率变化规律:_____________。