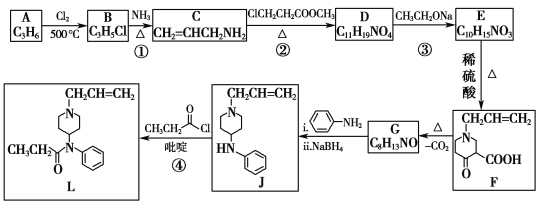
题目内容
【题目】金属钼(Mo)在工业和国防建设中有重要的作用。钼的常见化合价为+4、+5、+6。由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(![]() ),部分流程如下图所示:
),部分流程如下图所示:
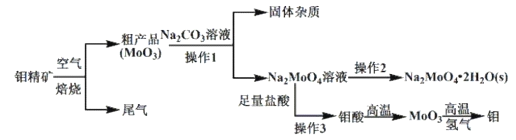
已知:钼酸微溶于水,可溶于碱溶液。
回答下列问题:
(1)钼精矿在空气中焙烧时,发生的主要方程式为_______________________。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,请你提出一种实验室除去该尾气的方法________________________。
(3)操作2的名称为_____________________ 、过滤、洗涤、干燥。
(4)实验室由钼酸经高温制MoO3,所用到的硅酸盐材料仪器的名称是_________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(![]() )=0.80 molL1、c(
)=0.80 molL1、c(![]() )=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的![]() 。当BaMoO4开始沉淀时,SO42的去除率是_________。[Ksp(BaSO4)=1.1
。当BaMoO4开始沉淀时,SO42的去除率是_________。[Ksp(BaSO4)=1.1![]() 1010、Ksp(BaMoO4)=4.0
1010、Ksp(BaMoO4)=4.0![]() 108,溶液体积变化可忽略不计。]
108,溶液体积变化可忽略不计。]
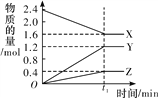
(6)焙烧钼精矿所用装置是多层焙烧炉,下图为各炉层固体物料的物质的量的百分数(![]() )。
)。
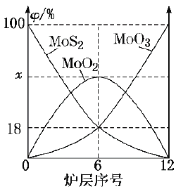
①x=___________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2,还原剂为_________。若反应中转移3mole-,则消耗的还原剂的物质的量为______________。
【答案】2MoS2+7O2 ![]() 2MoO3+4 SO2 可用氨水或氢氧化钠溶液吸收等其他合理答案 蒸发浓缩、冷却结晶 坩埚 95.6% 64 MoS2 0.25mol
2MoO3+4 SO2 可用氨水或氢氧化钠溶液吸收等其他合理答案 蒸发浓缩、冷却结晶 坩埚 95.6% 64 MoS2 0.25mol
【解析】
钼精矿(主要成分是MoS2)在空气中焙烧时生成MoO3和SO2,SO2会污染环境,粗产品MoO3在碳酸钠溶液中反应生成![]() ,经过一系列操作得到钼酸钠晶体(
,经过一系列操作得到钼酸钠晶体(![]() ),
),![]() 溶液加入足量盐酸生成钼酸,钼酸高温分解得到MoO3,MoO3与氢气在高温下反应生成Mo。
溶液加入足量盐酸生成钼酸,钼酸高温分解得到MoO3,MoO3与氢气在高温下反应生成Mo。
(1)钼精矿在空气中焙烧时生成MoO3和SO2,发生的主要方程式为2MoS2+7O2 ![]() 2MoO3+4 SO2;故答案为:2MoS2+7O2
2MoO3+4 SO2;故答案为:2MoS2+7O2 ![]() 2MoO3+4 SO2。
2MoO3+4 SO2。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,主要是二氧化硫会污染环境,一种实验室除去该尾气的方法是可用氨水或氢氧化钠溶液吸收;故答案为:可用氨水或氢氧化钠溶液吸收等(其他合理答案)。
(3)操作2是从溶液变为晶体,因此名称为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)实验室由钼酸经高温煅烧制的MoO3,所用到的硅酸盐材料仪器的名称是坩埚;故答案为:坩埚。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(![]() )=0.80 molL1、c(
)=0.80 molL1、c(![]() )=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的![]() 。当BaMoO4开始沉淀时,Ksp(BaMoO4)=4.0×108=0.80×c(Ba2+),此时钡离子浓度为c(Ba2+)=5.0×108 molL1,则根据Ksp(BaSO4)=1.1×1010=5.0×108×c(
。当BaMoO4开始沉淀时,Ksp(BaMoO4)=4.0×108=0.80×c(Ba2+),此时钡离子浓度为c(Ba2+)=5.0×108 molL1,则根据Ksp(BaSO4)=1.1×1010=5.0×108×c(![]() ),此时硫酸根浓度为c(
),此时硫酸根浓度为c(![]() )=2.2×103 molL1,
)=2.2×103 molL1,![]() 的去除率是
的去除率是![]() ;故答案为:95.6%。
;故答案为:95.6%。
(6)①由图中信息可知,6层中存在的固体物质分别为MoS2、MoO3、MoO2,图像分析MoS2、MoO3的物质的量百分比均为18%,根据Mo元素守恒,则MoO2的物质的量百分比为64%;故答案为:64%。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2,反应为MoS2 + 6MoO3 ![]() 7MoO2 + 2SO2,MoS2中S化合价升高,MoO3中Mo化合价降低,1mol MoS2反应转移12mol电子,因此还原剂为MoS2。若反应中转移3mole-,则消耗的还原剂的物质的量为
7MoO2 + 2SO2,MoS2中S化合价升高,MoO3中Mo化合价降低,1mol MoS2反应转移12mol电子,因此还原剂为MoS2。若反应中转移3mole-,则消耗的还原剂的物质的量为![]() ;故答案为:0.25mol。
;故答案为:0.25mol。

 名校课堂系列答案
名校课堂系列答案