题目内容
15.近年来,我国在超导体材料研究方面居于世界领先地位,铊(Tl)是超导体的组成成分之 一,铊位于第6周期ⅢA族.下列对铊的性质的推导正确的是( )①是易导电的银白色金属
②Tl(OH)3是两性氢氧化物
③Tl3+氧化能力比Al3+强
④单质能与稀硝酸反应生成硝酸盐.
| A. | ①④ | B. | ②③ | C. | ① | D. | ④ |
分析 铊和铝都位于周期表第ⅢA族,原子核外有3个电子,最高化合价为+3价,能形成+3价的离子化合物,同主族元素从上到下元素的金属性逐渐增强,对应金属单质的熔点逐渐降低,硬度减小.
解答 解:①同主族元素从上到下元素的金属性逐渐增强,具有强氧化性,所以为易导电的银白色金属,故正确;
②同主族元素从上到下元素的金属性逐渐增强,则铊的金属性强于铝,所以Tl(OH)3不是两性氢氧化物,故错误;
③从上到下金属单质的还原性依次增强,所以Tl>Al,对应最高价阳离子的还原性就越弱,所以Tl3+的氧化性比Al3+弱,故错误;
④硝酸具有强氧化性,与金属反应生成NO或NO2、硝酸盐,故正确.
故选A.
点评 本题考查同主族元素的性质的递变规律,题目难度不大,本题注意把握相关性质的递变规律.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
5.下列操作只涉及物理变化的是( )
| A. | 用玉米酿酒 | B. | 用浓硫酸干燥氧气 | ||
| C. | 用稀硫酸除铁锈 | D. | 用铁矿石冶炼生铁 |
3.某微粒的结构示意图为 ,它表示( )
,它表示( )
 ,它表示( )
,它表示( )| A. | 氧原子 | B. | 氧离子 | C. | 氖原子 | D. | 钠离子 |
10.以下两反应达到平衡后分别加入少量H${\;}_{2}^{18}$O,重新达平衡时,含18O的物质分别是( )
①CO+H2O?CO2+H2 ②CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O.
①CO+H2O?CO2+H2 ②CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O.
| A. | 2种 3种 | B. | 3种 2种 | C. | 3种 4种 | D. | 2种 2种 |
1.体积相等的四个密闭容器中进行同样的可逆反应:2A(g)+B(g)?3C(g)+2D(g),起始时
四个容器所盛A、B的物质的量分别为相同温度下建立平衡时,A或B的转化率(α)大小关系正确的是( )
| 甲 | 乙 | 丙 | 丁 | |
| A/mol | 2 | 1 | 2 | 1 |
| B/mol | 1 | 1 | 2 | 2 |
| A. | αA:甲<乙<丙<丁 | B. | αA:甲<丁<丙<乙 | C. | αB:甲<丙<乙<丁 | D. | αB:丁<丙<乙<甲 |
8.关于元素周期表的叙述中,不正确的是( )
| A. | 俄国化学家门捷列夫编制了第一个元素周期表 | |
| B. | 元素周期律是由原子核外电子排布的周期性变化引起的 | |
| C. | 在元素周期表的过渡元素区域中寻找制催化剂的元素 | |
| D. | 元素周期表中最右上角元素的非金属性最强 |
5.下列叙述中正确的是( )
| A. | 实验室欲配制480mL0.10mol•L-1的CuSO4溶液,可用12.0g胆矾及相应容器配制 | |
| B. | 将适量FeCl3饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| C. | 实验室中从海带里提取碘的过程是:灼烧→溶解→过滤→萃取 | |
| D. | 用分液漏斗、烧杯、铁架台(带铁圈)、饱和Na2CO3溶液可除去乙酸乙酯中的乙酸 |
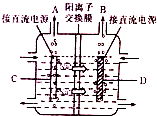 氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.
氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.