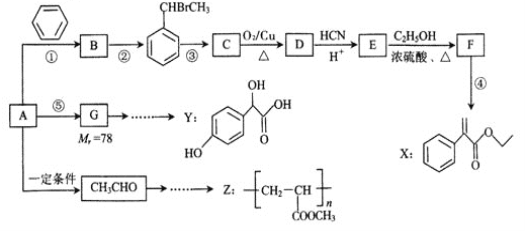
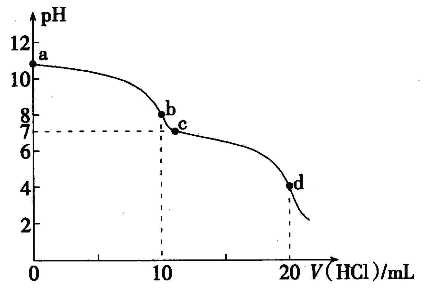
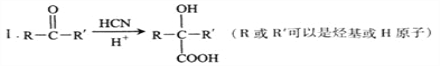题目内容
【题目】氮氧化物是形成酸雨的成因之一,与其他污染物在一定条件下能产生光化学烟雾,加大对氮氧化物的处理是环境治理的重要研究内容。
(1)NH3催化NOx是目前应用最广泛的烟气氮氧化物脱除技术。
已知.①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1
2N2(g)+6H2O(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③H2O(g)=H2O(l) △H3
则反应4NH3(g)+6NO(g)![]() N2(g)+6H2O(l) △H=______(用含△H1、△H2和△H3的式子表示)。
N2(g)+6H2O(l) △H=______(用含△H1、△H2和△H3的式子表示)。
(2)科学家用活性炭还原法可以消除NO的污染,发生的反应为C(s)+2N0(g)![]() N2(g)+CO2(g)。lmolNO和足量的活性炭在T℃、容积恒定为1L的密闭容器中反应,经过10min反应达到平衡,测得NO的物质的量为0.5mol。
N2(g)+CO2(g)。lmolNO和足量的活性炭在T℃、容积恒定为1L的密闭容器中反应,经过10min反应达到平衡,测得NO的物质的量为0.5mol。
①10min内,平均反应速率v(N2)=______,在T℃时,该反应的平衡常数K=_______。
②能判断该反应一定达到化学平衡状态的依据是______(填标号)。
a.单位时间内生成2nmolNO的同时消耗nmolCO2
b.反应体系的温度不再发生改变
c.恒容条件下,混合气体的密度不再发生改变
d.恒温恒容条件下,反应体系的压强不再发生改变
(3)电化学住化净化NO是一种新颖的处理氮氧化物的方法。原理如下图,固体电解质起到传导O2-的作用,则通入NO的电极反应式为________。
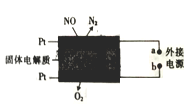
(4)已知:25℃时,HNO2的电离常数Ka=7.1×10-4,CH3COOH的电离常数K=1.8×10-5,实验室时可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。②③
①已知溶液甲为浓度均为0.1mol· L-1,的NaNO3和NaNO2的混合溶液,溶液乙为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_______,能使溶液甲和溶液乙的pH相等的方法是_______(填标号)。
a.向溶液甲中加适量水 b. 向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d. 向溶液乙中加适量NaOH
②25℃时,向0.1mol·L-1CH3COOH溶液中加入一定量的CH3COONa溶液,使溶液中c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=_______。
【答案】 △H1-3△H2+6△H3 0.025mol/(L·min) 0.25 bc 2NO+4e-=N2+2O2- c(NO3-)>c(NO2)>c(CH3COO-) bc 5
【解析】(1)本题考查热化学反应方程式的计算,①-②×3+6×③得出△H= △H1-3△H2+6△H3;(2)本题考查化学反应速率的计算、化学平衡常数的计算、化学平衡状态的判断,①根据化学反应速率的数学表达式,v(NO)=(1-0.5)/(1×10)mol/(L·min)=0.05 mol/(L·min),依据化学反应速率之比等于化学计量数之比,因此有v(N2)=v(NO)/2=0.025mol/(L·min),C(s)+2NO(g) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始浓度: 1 0 0
变化浓度: 0.5 0.25 0.25
平衡浓度: 0.5 0.25 0.25 根据化学平衡常数的定义,K= ![]() =
= ![]() =0.25;a、用不同物质的反应速率表示达到平衡,要求反应方向一正一逆,消耗CO2和生成NO,反应都是向逆反应方向进行,故a错误;b、化学反应不是吸热反应就是放热反应,因此当温度不变,说明反应达到平衡,故b正确;c、密度=气体质量/气体体积,因为是恒容,因此气体体积不变,C是固体,向正反应方向进行,气体质量增大,因此密度不变,说明反应达到平衡,故c正确;d、反应前后气体的系数之和相等,因此压强不变,不能说明反应达到平衡,故d错误;(3)考查电极反应式的书写,根据示意图,NO转化成N2,2NO-4e-=N2+O2-;(4)本题考查离子浓度大小比较、溶液pH的计算,①硝酸是强酸,NaNO3是强酸强碱盐,因此等浓度时c(NO3-)最大,比较HNO2和CH3COOH的电离平衡常数,电离常数越大,说明酸性越强,其水解程度越弱,因此等浓度的NaNO2和CH3COONa中c(NO2-)>c(CH3COO-),因此离子浓度大小顺序是c(NO3-)>c(NO2-)>c(CH3COO-),根据上述分析,CH3COO-的水解程度大于NO2-的水解程度,相同浓度时CH3COONa溶液的pH大于NaNO2溶液的pH,a、向溶液甲中加水,溶液的pH小于溶液乙,不会与溶液乙的pH相等,故a错误;b、NaOH是强碱,因此加入适量的NaOH,溶液甲中的pH会等于溶液乙中pH,故b正确;c、溶液乙中加入适量的水,稀释溶液,溶液的pH的降低,与溶液甲的pH会相等,故c正确;d、溶液乙中加入NaOH,溶液乙的pH更大于容易甲,故d错误;②根据电离平衡常数,Ka=
=0.25;a、用不同物质的反应速率表示达到平衡,要求反应方向一正一逆,消耗CO2和生成NO,反应都是向逆反应方向进行,故a错误;b、化学反应不是吸热反应就是放热反应,因此当温度不变,说明反应达到平衡,故b正确;c、密度=气体质量/气体体积,因为是恒容,因此气体体积不变,C是固体,向正反应方向进行,气体质量增大,因此密度不变,说明反应达到平衡,故c正确;d、反应前后气体的系数之和相等,因此压强不变,不能说明反应达到平衡,故d错误;(3)考查电极反应式的书写,根据示意图,NO转化成N2,2NO-4e-=N2+O2-;(4)本题考查离子浓度大小比较、溶液pH的计算,①硝酸是强酸,NaNO3是强酸强碱盐,因此等浓度时c(NO3-)最大,比较HNO2和CH3COOH的电离平衡常数,电离常数越大,说明酸性越强,其水解程度越弱,因此等浓度的NaNO2和CH3COONa中c(NO2-)>c(CH3COO-),因此离子浓度大小顺序是c(NO3-)>c(NO2-)>c(CH3COO-),根据上述分析,CH3COO-的水解程度大于NO2-的水解程度,相同浓度时CH3COONa溶液的pH大于NaNO2溶液的pH,a、向溶液甲中加水,溶液的pH小于溶液乙,不会与溶液乙的pH相等,故a错误;b、NaOH是强碱,因此加入适量的NaOH,溶液甲中的pH会等于溶液乙中pH,故b正确;c、溶液乙中加入适量的水,稀释溶液,溶液的pH的降低,与溶液甲的pH会相等,故c正确;d、溶液乙中加入NaOH,溶液乙的pH更大于容易甲,故d错误;②根据电离平衡常数,Ka= ,解得c(H+)=1×10-5,因此pH=5。
,解得c(H+)=1×10-5,因此pH=5。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
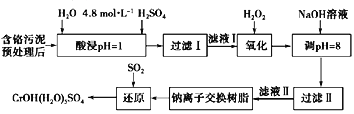
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol·L-1的浓硫酸配制250mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸___________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________________。(答出两点)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4 (>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.滤液Ⅱ中阳离子主要有_________;但溶液的pH不能超过8,其理由是_______________________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是__________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:______________________ 。
【题目】现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
A | 中和反应 | ----------- | 溶解 | 产生氢气 |
B | ----------- | 有银镜 | 加热后有红色沉淀 | 产生氢气 |
C | 水解反应 | 有银镜 | 加热后有红色沉淀 | ----------- |
D | 水解反应 | ----------- | ----------- | ----------- |
(1)B分子中官能团的名称是:____________
(2)B、C的结构简式分别为:B_________________,C_________________。
(3)D在NaOH溶液中反应的化学方程式为______________________________。
(4)写出B与银氨溶液反应的化学方程式:_______________________________。
(5)属于A的同系物且比A少一个碳原子的物质E的同分异构体有(写结构简式)____________________。
【题目】在一定条件下进行反应:COCl2(g) ![]() Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0molCOCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0molCOCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是
A. 生成Cl2的平均反应速率:0~2s比2~4s快
B. 0~2s COCl2的平均分解速率为 0.15mol L-1·s-1
C. 6s时,反应达到最大限度
D. 该条件下,COCl2的最大转化率为60%