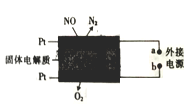
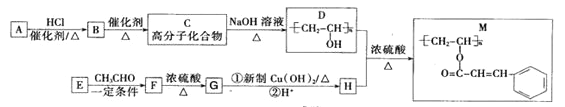
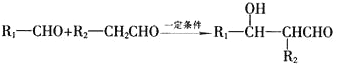
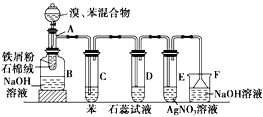
题目内容
【题目】在一定条件下进行反应:COCl2(g) ![]() Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0molCOCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0molCOCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是
A. 生成Cl2的平均反应速率:0~2s比2~4s快
B. 0~2s COCl2的平均分解速率为 0.15mol L-1·s-1
C. 6s时,反应达到最大限度
D. 该条件下,COCl2的最大转化率为60%
【答案】BD
【解析】A、根据表中数据可知,在0~2s中氯气变化了0.3mol,在2~4s中氯气变化了0.09mol,所以生成Cl2的平均反应速率,0~2s比2~4s快,A正确;B、在0~2s中氯气增加了0.3mol,根据化学方程式可知,用去COCl2气体为0.3mol,浓度是0.15mol/L,所以平均分解速率为0.15mol/L÷2s=0.075molL-1s-1,B错误;C、6s之后,氯气的物质的量不再变化,说明反应已经处于平衡状态,C正确;D、根据表中数据,平衡时生成氯气0.4mol,即用去COCl2的物质的量为0.4mol,所以转化率为0.4/1×100%=40%,D错误;答案选BD。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目