题目内容
【题目】亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如图: 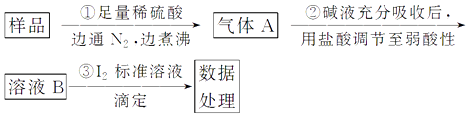
(1)碘标准液应选用(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行、洗涤、润洗.
(2)锥形瓶内的指示剂为 , 判断达到滴定终点的依据 .
(3)下列操作会使测定结果偏大的有
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品wg,按乙方案测得消耗0.010molL﹣1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示).
【答案】
(1)酸式;验漏(或查漏)
(2)淀粉溶液;溶液由无色变为浅蓝色,且半分钟不褪色
(3)B
(4)![]()
【解析】解:(1)碘标准液能腐蚀橡胶,不能用碱式滴定管,而用酸式滴定管.加注标准液之前必须对滴定管进行检漏,所以答案是:酸式;检漏;(2)亚硫酸盐或是亚硫酸氢盐与碘单质反应:HSO3﹣+I2+H2O=SO42﹣+2I﹣+3H+.碘遇淀粉变蓝色,用碘标准溶液滴定亚硫酸盐或是亚硫酸氢盐,可以使用淀粉溶液作指示剂,当蓝色消失时,反应恰好发生,即达到终点时的现象为:溶液由无色变为蓝色,且半分钟内不褪色.所以答案是:淀粉溶液;滴最后一滴时,溶液由无色变为浅蓝色,且半分钟不褪色;(3)A.起始读数时平视,终点读数时俯视,会造成V(标准)偏小,根据c(待测)= ![]() 分析,会造成c(待测)偏低,故A错误;
分析,会造成c(待测)偏低,故A错误;
B.未用标准液润洗滴定管.会造成V(标准)偏大,根据c(待测)= ![]() 分析,会造成c(待测)偏高,故B正确;
分析,会造成c(待测)偏高,故B正确;
C.步骤①中用稀盐酸代替稀硫酸.用盐酸代替硫酸,生成的SO2气体中混有少量HCl,因SO2用碱液吸收后需再用盐酸调节溶液至弱酸性,因此混合气体中含有HCl,对实验结果无影响.故C错误;(4)反应的离子方程式为H2O+SO32﹣+I2=SO42﹣+2H++2I﹣,
SO2~SO32﹣~ | I2 |
64g | 1mol |
m | 0.01000molL﹣1×V×10﹣3L=10﹣5mol |
m=64×V×10﹣5g,则1kg样品中含SO2的质量为 ![]() =
= ![]() ,
,
所以答案是: ![]() .
.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使电解液复原的组合是( )
X | Y | Z | W | |
A | C | Fe | NaCl | H2O |
B | Pt | Cu | CuSO4 | CuSO4溶液 |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3晶体 |
A. A B. B C. C D. D








