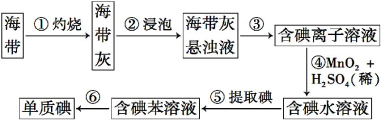
题目内容
【题目】室温时,0.1 mol/L某酸HA溶液的pH=3。关于该溶液叙述正确的是
A. 溶质的电离方程式为HA→H+ + A- B. 升高温度,溶液的pH增大
C. 若加入少量NaA固体,则c(A-)降低 D. 该溶液稀释10倍后,pH < 4
【答案】D
【解析】室温时,0.1molL-1某一元酸 HA的水溶液 pH=3,则溶液中c(H+)=10-3mol/L,该酸为弱酸;溶质的电离方程式为HA![]() H+ + A-,A错误;电离过程为吸热过程,升高温度,平衡右移,氢离子浓度增大,溶液的pH减小,B错误;若加入少量NaA固体,虽然平衡左移,但是移动过程微弱,增加了溶液中c(A-),C错误;弱酸稀释10n倍时,溶液的pH变化小于n个单位,所以将该溶液稀释10倍后,pH 介于3 至4之间, D正确;正确选项D。
H+ + A-,A错误;电离过程为吸热过程,升高温度,平衡右移,氢离子浓度增大,溶液的pH减小,B错误;若加入少量NaA固体,虽然平衡左移,但是移动过程微弱,增加了溶液中c(A-),C错误;弱酸稀释10n倍时,溶液的pH变化小于n个单位,所以将该溶液稀释10倍后,pH 介于3 至4之间, D正确;正确选项D。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目