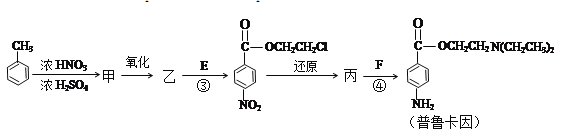
��Ŀ����
����Ŀ����һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ(��֪��Ӧ���̷���)���������������ֺ���Ԫ�ص����ӣ�����ClO����ClO3���������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���ı仯ʾ��ͼ����ͼ��ʾ������˵����ȷ���ǣ� ��
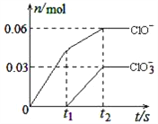
A. ���Լ���Һ��KOH�����ʵ�����0.09mol
B. ClO3�����������������������Ķ��������
C. ������������ClO����ClO3��������Cl2
D. ��Ӧ��ת�Ƶ��ӵ����ʵ�����0.21mol
���𰸡�D
�����������������A������������������Һ��Ӧ���ɴ�����ء��Ȼ��غ�����أ�����ͼ��֪n��ClO-��=0.06mol��n��ClO3-��=0.03mol�����ݵ���ת���غ��֪���ɵ�������n��Cl-��=0.06mol����1-0��+0.03mol����5-0��=0.21mol�����������غ��֪n��K+��=n��Cl-��+n��ClO-��+n��ClO3-��=0.21mol+0.06mol+0.03mol=0.3mol�����������ص����ʵ���=0.3mol��A����B����0��t1��û��ClO3�������ɣ�˵�����¶��йأ�B����C��ClO����ClO3�������ܿ�����Cl2����Ϊ�����ܶ��õ��ӣ�C����D����Ӧ��ת�Ƶ��ӵ����ʵ�����0.21mol��D��ȷ����ѡD

 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�