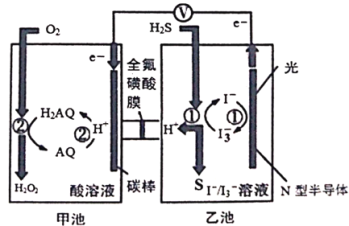
题目内容
【题目】.高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO42-+8H+
B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH-
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变
【答案】B
【解析】
A.铁是阳极,电极反应为Fe-6e-+8OH-═FeO42-+4H2O,碱性条件下不能生成氢离子,故A错误;
B.镍电极上氢离子放电生成氢气,电极反应式为2H2O+2e-═H2↑+2OH-,故B正确;
C.电解池中阴离子移向阳极,所以OH-自左向右移动,故C错误;
D.电解时阳极区消耗氢氧根pH降低、阴极区生成氢氧根pH升高,电解池总反应为:Fe+2H2O+2OH-═FeO42-+3H2↑,则混合溶液中氢氧根离子浓度减小,溶液的pH降低,故D错误;
故选:B。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】(1)填写下列表格:
物质 | 分子数 | 质量/g | 物质的量/ mol | 摩尔质量/(g |
O2 | __ | 8.0 | __ | __ |
H2SO4 | 3.01×1023 | __ | __ | __ |
H2O | __ | __ | 0.5 | __ |
(2)147gH2SO4的物质的量是____;0.5molH2SO4的质量是____g,其中含有____mol H;2 mol H2SO4中含有H2SO4分子数为_____个,含氢原子数为____个。
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为____,R的相对原子质量为____。含R的质量为1.6 g的Na2R,其物质的量为____。
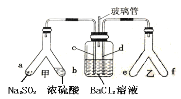
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
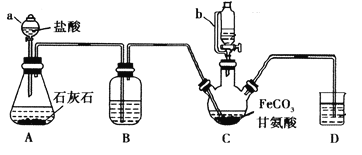
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。