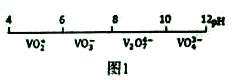
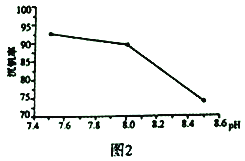
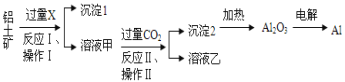
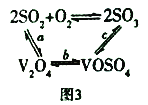题目内容
【题目】某有机物的结构简式如图所示,下列说法中不正确的是( )
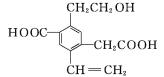
A.1 mol该有机物和过量的金属钠反应最多可以生成1.5 mol H2
B.该有机物最多消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C.可以用酸性KMnO4溶液检验其中的碳碳双键
D.该有机物能够在催化剂作用下发生酯化反应
【答案】C
【解析】
A.1mol-OH和钠反应生成0.5mol的氢气,2mol-COOH和钠反应生成1mol的氢气,1 mol该有机物和过量的金属钠反应最多可以生成1.5 mol H2,正确,A不符合题意;
B.1mol羟基和2mol羧基共消耗3mol钠,2mol羧基共消耗2molNaOH,2mol羧基共消耗2molNaHCO3,所以该有机物最多消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
正确,B不符合题意;
C.结构中的醇羟基,苯环的侧链均能和酸性高锰酸钾反应,所以不能用酸性KMnO4溶液检验其中的碳碳双键,错误,C符合题意;
D.该有机物含有-OH和-COOH,能够在催化剂作用下与酸发生酯化反应,正确,D不符合题意。
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1 h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01molL-1KMnO4溶液,几滴浓H2SO4 | 2 mL0.3molL-1 H2C2O4溶液 | 2 | 褪为无色 |
b | 4mL0.01molL-1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01molL-1K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01molL-1K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:___________。
(2)实验Ⅰ试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为__________。
(3)瑛瑛和超超查阅资料,实验Ⅰ试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
实验 操作 |
|
|
|
实验 现象 | 6min后固体完全溶解,溶液橙色变浅,温度不变 | 6min后固体未溶解,溶液颜色无明显变化 | 6min后固体未溶解,溶液颜色无明显变化 |
实验Ⅳ的目的是:_______________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72-浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i:MnO2与H2C2O4反应生成了Mn2+。
过程ii:___________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001mol MnO2加入到6mL______中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到________________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案如下:将2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/LK2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体,6分钟后现象为:______________
(5)综合以上实验可知,草酸发生氧化反应的速率与____________有关。
【题目】工业上制备 BaCl2·2H2O有如下两种途径。
途径 1:以重晶石(主要成分BaSO4)为原料,流程如下:
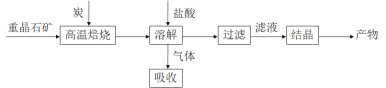
(1)写出“高温焙烧”时反应的化学方程式:_____________________________________。
(2)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为_____________。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
途径 2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等杂质)为原料,流程如下:
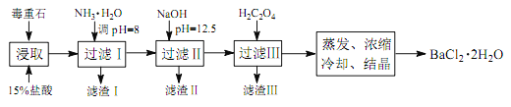
已知:Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(4)为提高矿石的浸取率,可采取的措施是_________。
(5)加入 NH3·H2O 调节 pH=8 可除去___________(填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(6)重量法测定产品纯度的步骤为:准确称取 m g BaCl2·2H2O试样,加入100 mL水, 用3 mL 2 mol·L-1 的 HCl溶液加热溶解。边搅拌,边逐滴加入0.1 mol·L-1 H2SO4 溶液。待BaSO4完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为n g。则BaCl2·2H2O的质量分数为_________。
(7)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如图所示。下列叙述正确的是_______________
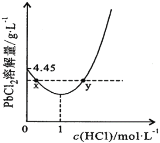
A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)