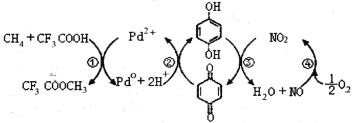
��Ŀ����
����Ŀ����������һ����;�ܹ�Ļ�����Ʒ�����Ժ�Σ����С���ǰ�ȫ�Ժܸߵ��л��ܼ�����������Ȼ���ϳ���֬����֬�����л������������ȶ��к�ǿ���ܽ�������������Ϊ���Ӽ���ϴ���Ͷ����л��ϳɲ��ϡ���ͨ�����·�Ӧԭ����ȡ�����ѣ�
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
��֪������ʵIJ�����Ϣ���£�
�е�(��) | �ܶ�(g/cm3) | �ܽ��(g) | ��Է������� | |
������ | 117.7 | 0.81 | 7.9 | 74 |
������ | 142 | 0.77 | ������ˮ | 130 |
ij���⻯ѧѧϰС���������������������ʵ�鲽��ϳ������ѣ�
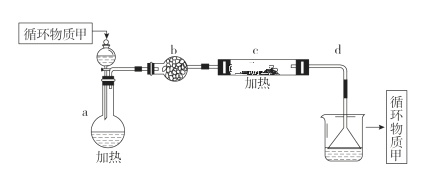
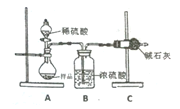
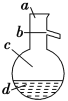
����100 mL������ƿ�м���30.0 mL��������5.0 mLŨ����ͼ�����ʯ�����ҡ�ȡ��ڷ�ˮ���м���3.0 mL����ʳ��ˮ����ͼ����װ��������ͨ����ˮ��
�ڷ�Ӧ���ڵ������ϼ��ȣ�ʹƿ��Һ���У�������ӦԼ1Сʱ������Һ������ˮ��ʱ����ˮ���ų�һ����ˮ����ˮ�㲻�ٱ仯��ƿ�з�Ӧ�¶ȴ�150 �棬��Ӧ��������ɣ�ֹͣ���ȣ�
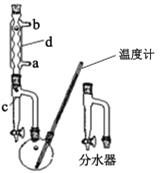
��������ӦҺ��ȴ���·�ˮ�����������ij�����װ����ͼ�����ټӼ�����ʯ�������ռ���֣�
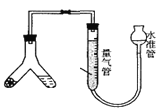
�ܾ��ƣ������Һ����ʢ��10 mLˮ�ķ�Һ©���У������ҡ��������ȥˮҺ���л���������5 mLˮ��3 mL 5% NaOH��Һ��3 mLˮ��3 mL�����Ȼ�����Һϴ�ӣ���ȥˮ�㣬���������ྻ�����С��ƿ�У�Ȼ�����0.2��0.4 9��ˮ�Ȼ��ƣ��ٽ�Һ��ת��װ�ñ��н��������ռ������9.0 mL��
��.  ��.
��. ![]() ��.
��.
��������ϲ����ش��������⣺
(1)�Ʊ������ѵķ�Ӧ������___������d��������____��
(2)�ڲ�����������Լ���˳����____�����װ���ң�װ�ü��ŵ��� ___��
(3)�ڲ�����в��õ������ȶ������þƾ���ֱ�Ӽ��ȵ�ԭ�������____��
(4)�ڲ�������ռ�������˵��¶ȷ�ΧΪ____(����ȷ�𰸱��)��
A.115�桫ll9�� B.140�桫144�� C. 148�桫152��
(5)�ھ����У��л�����____��(����������������)��������ˮ�Ȼ��Ƶ�������____��
(6)��С��ʵ������������ѵIJ���ԼΪ ___%(����������һλС��)��
���𰸡�ȡ����Ӧ ���������� �ȼ����������ټ�Ũ���� װ�ü���ˮ�����������ڷ�Ӧ�з����ˮ�����������ת���ʣ����ڼ�װ�������¶ȼƣ����ڲⶨ��Ӧ�¶� �������ȸ����ȣ������Ƽ����¶� B �� ���������� 32.5
��������
��1���Ʊ������ѵķ�ӦΪ��2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O���䷴Ӧ������ȡ����Ӧ������d�����������������ܣ��ʴ�Ϊ��ȡ����Ӧ�����������ܡ�
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O���䷴Ӧ������ȡ����Ӧ������d�����������������ܣ��ʴ�Ϊ��ȡ����Ӧ�����������ܡ�
��2��Ũ����������Һ����ʱ���ȼ�����Һ�������ᣬ��ֹŨ����ϡ��ʱ���ȣ�����Һ��ɽ��������ڲ�����������Լ���˳�����ȼ����������ټ�Ũ���ᣬװ�ü���ˮ�����������ڷ�Ӧ�з����ˮ�����������ת���ʣ����ڼ�װ�������¶ȼƣ����ڲⶨ��Ӧ�¶ȣ��ʴ�Ϊ���ȼ����������ټ�Ũ���װ�ü���ˮ�����������ڷ�Ӧ�з����ˮ�����������ת���ʣ����ڼ�װ�������¶ȼƣ����ڲⶨ��Ӧ�¶ȡ�
��3���������ȸ����ȣ������Ƽ����¶ȣ��ʴ�Ϊ���������ȸ����ȣ������Ƽ����¶ȡ�
��4�����ݱ����֪�������ѵķе���142�棬�����ռ�������˵��¶ȷ�ΧӦ��142�����ң�ѡB���ʴ�Ϊ��B��
��5�����ݱ����֪�������ѵ��ܶ�Ϊ0.77g/cm3��С��ˮ���ܶȣ������л��������棬�����Ѳ�����ˮ������ˮ�Ȼ��Ƹ��������ѣ��ʴ�Ϊ���ϣ����������ѡ�
��6�������۲���Ϊx�����ݷ�Ӧԭ����2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O�ɵã�
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O�ɵã�![]() ��x
��x![]() 21.34g��ʵ���ռ�����������Ϊ9.0 mL��������Ϊ9.0 mL��0.77g/cm3=6.93g�������Ϊ
21.34g��ʵ���ռ�����������Ϊ9.0 mL��������Ϊ9.0 mL��0.77g/cm3=6.93g�������Ϊ![]() ���ʴ�Ϊ��32.5��
���ʴ�Ϊ��32.5��

 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�����Ŀ����ҵ���Ʊ� BaCl2��2H2O����������;����
;�� 1�����ؾ�ʯ����Ҫ�ɷ�BaSO4��Ϊԭ�ϣ��������£�
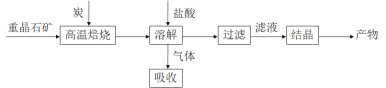
��1��д�������±��ա�ʱ��Ӧ�Ļ�ѧ����ʽ��_____________________________________��
��2�������ù���NaOH��Һ���գ��õ����ơ�Na2Sˮ������ӷ���ʽΪ_____________��
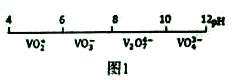
��3����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ��![]() =___________�� [Ksp(AgBr)=5.4��10-13��Ksp(AgCl)=2.0��10-10]
=___________�� [Ksp(AgBr)=5.4��10-13��Ksp(AgCl)=2.0��10-10]
;�� 2���Զ���ʯ(��Ҫ�ɷ�BaCO3����Ca2+��Mg2+��Fe3+������)Ϊԭ�ϣ��������£�
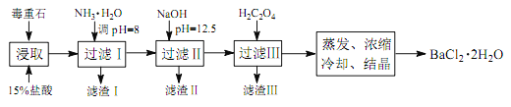
��֪��Ksp(BaC2O4)��1.6��10��7�� Ksp(CaC2O4)��2.3��10��9
Ca2+ | Mg2+ | Fe3+ | |
��ʼ����ʱ�� pH | 11.9 | 9.1 | 1.9 |
��ȫ����ʱ�� pH | 13.9 | 11.1 | 3.7 |
��4��Ϊ��߿�ʯ�Ľ�ȡ�ʣ��ɲ�ȡ�Ĵ�ʩ��_________��
��5������ NH3��H2O ���� pH=8 �ɳ�ȥ___________�������ӷ��ţ����������к�_________���ѧʽ�������� H2C2O4ʱӦ���������ԭ����_________��
��6���������ⶨ��Ʒ���ȵIJ���Ϊ��ȷ��ȡ m g BaCl2��2H2O����������100 mLˮ�� ��3 mL 2 mol��L��1 �� HCl��Һ�����ܽ⡣�߽��裬����μ���0.1 mol��L��1 H2SO4 ��Һ����BaSO4��ȫ�������ˣ���0.01 mol��L��1 ��ϡH2SO4ϴ�ӳ��� 3~4 �Σ�ֱ��ϴ��Һ�в���Cl��Ϊֹ�����������������о�������������أ�����Ϊn g����BaCl2��2H2O����������Ϊ_________��
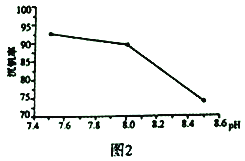
��7��20��ʱ��PbCl2(s)�ڲ�ͬŨ�������е�����ܽ���(��λ��g��L-1)��ͼ��ʾ������������ȷ����_______________
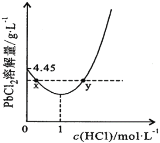
A������Ũ��Խ��Ksp(PbCl2)Խ��
B��PbCl2����һ��Ũ�ȵ����ᷴӦ
C��x��y�����Ӧ����Һ��c(Pb2+)���
D������Pb2+����Һ�м������Ũ���ᣬ�ɽ�Pb2+��ȫת��ΪPbCl2(s)