题目内容
【题目】溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是 {已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
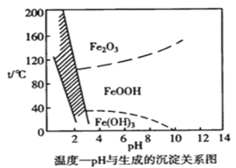
A.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
B.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
C.用氯酸钠在酸性条件下氧化Fe2+ 离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
D.在25℃时溶液经氧化,调节溶液pH=4 ,此时溶液中c(Fe3+)=2.64×10-9 mol·L-1
【答案】B
【解析】
A. 由图像可知,生成黄铁矾钠所需要的合适温度为85℃~95℃,pH=1.5左右,故A正确,
B.根据图像,pH=6温度从80℃升高至150℃,FeOOH分解成Fe2O3,沉淀没有被氧化,故B错误;
C. ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应,反应的离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故C正确;
D.25℃ pH=4时,c(OH-)=1×10-10mol/L,Fe(OH)3的Ksp=2.64×10-39,则c(Fe3+)=2.64×10-39÷(1×10-10)3=2.64×10-9(mol/L),故D正确;
答案为B。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目