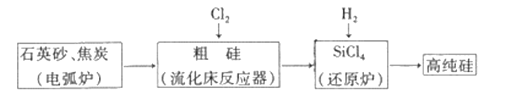
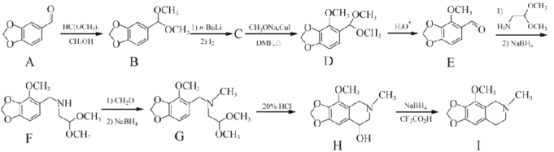
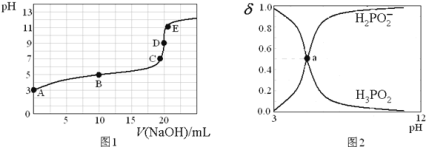
题目内容
【题目】常温下,含碳微粒![]() 、
、![]() 、
、![]() 存在于
存在于![]() 草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数
草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数![]() 某微粒物质的量浓度与三种微粒物质的量浓度和比值
某微粒物质的量浓度与三种微粒物质的量浓度和比值![]() 与溶液pH的关系如图所示,下列有关说法错误的是
与溶液pH的关系如图所示,下列有关说法错误的是![]()
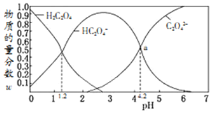
A.向![]() 的溶液中加NaOH溶液将pH增大至
的溶液中加NaOH溶液将pH增大至![]() 的过程中水的电离度一直增大
的过程中水的电离度一直增大
B.![]() 时,溶液中c
时,溶液中c![]()
![]()
![]()
C.![]() 若草酸的第二级电离平衡常数为
若草酸的第二级电离平衡常数为![]() ,则
,则![]()
D.将![]() 相同物质的量浓度
相同物质的量浓度![]() 和
和![]() 的两份溶液等体积混合,可配得图a点所示混合液
的两份溶液等体积混合,可配得图a点所示混合液
【答案】D
【解析】
![]() 向
向![]() 的溶液中加KOH溶液将pH增大至
的溶液中加KOH溶液将pH增大至![]() ,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,选项A正确;
,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,选项A正确;
B.![]() 时,
时,![]() ,溶液中存在物料守恒,
,溶液中存在物料守恒,![]() ,
,![]() ,选项B正确;
,选项B正确;
C.![]() 时,
时,![]() ,
,![]() ,选项C正确;
,选项C正确;
D.将![]() 相同物质的量浓度
相同物质的量浓度![]() 和
和![]() 的两份溶液等体积混合,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为
的两份溶液等体积混合,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为![]() ,选项D错误;
,选项D错误;
答案选D。

【题目】实验室用少量的溴和足量的乙醇制备1,![]() 二溴乙烷的装置如图所示:
二溴乙烷的装置如图所示:
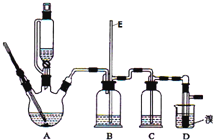
提示:乙醇与浓硫酸在![]() 时脱水生成乙醚,在
时脱水生成乙醚,在![]() 时脱水生成乙烯.有关数据列表如下:
时脱水生成乙烯.有关数据列表如下:
乙醇 | 1, | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度 | 0.79 | 2.2 | 0.71 |
沸点 | 78.5 | 132 | 34.6 |
熔点 | -130 | 9 | -116 |
回答下列问题:
![]() 装置D中发生主要反应的化学方程式为 ______
装置D中发生主要反应的化学方程式为 ______
![]() 装置B的作用 ______ ,长玻璃管E的作用 ______
装置B的作用 ______ ,长玻璃管E的作用 ______
![]() 在装置C中应加入 ______ ,其目的是吸收反应中可能生成的酸性气体
在装置C中应加入 ______ ,其目的是吸收反应中可能生成的酸性气体![]() 填正确选项前的字母
填正确选项前的字母![]()
![]() 水
水![]() 浓硫酸
浓硫酸![]() 氢氧化钠溶液
氢氧化钠溶液![]() 饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
![]() 反应过程中应用冷水冷却装置D,其主要目的是 ______ ;但又不能过度冷却
反应过程中应用冷水冷却装置D,其主要目的是 ______ ;但又不能过度冷却![]() 如用冰水
如用冰水![]() ,其原因是 ______ ;将1,
,其原因是 ______ ;将1,![]() 二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ______ 层
二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ______ 层![]() 填“上”、“下”
填“上”、“下”![]()
![]() 若产物中有少量未反应的
若产物中有少量未反应的![]() ,最好用 ______ 洗涤除去
,最好用 ______ 洗涤除去![]() 填正确选项前的字母
填正确选项前的字母![]()
![]() 水
水![]() 氢氧化钠溶液
氢氧化钠溶液![]() 碘化钠溶液
碘化钠溶液![]() 乙醇
乙醇