��Ŀ����
����Ŀ����(Mo)��һ�ֹ��ɽ���Ԫ�أ�ͨ�������Ͻ���ֵ����Ӽ��������ƾ���(Na2MoO4��2H2O)��һ����������ȴˮϵͳ�Ľ�����ʴ������ҵ�������⾫��(��Ҫ�ɷ���MoS2����������PbS��)�Ʊ������ƾ������Ҫ������ͼ��ʾ��

(1)Na2MoO4��2H2O����Ԫ�صĻ��ϼ���___________���ᾧ�õ����������ƾ���Ĵֲ�Ʒ��Ҫ�õ������������ƾ��壬����Ҫ���еIJ�����___________(������)��
(2)���չ������⾫��������Ҫ��ѧ��Ӧ����ʽΪMoS2+O2��MoO3+SO2(δ��ƽ)���÷�Ӧ������������___________��
(3)д�����������Ӧ�����ӷ���ʽ��_____��Ϊ������߸÷�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��_____��
(4)���Һ�ᾧǰ�����Ba(OH)2�����Գ�ȥSO42������BaMoO4��ʼ����ʱ��SO42����ȥ������____________%[��֪�����Һ��c(MoO42��)=0.40mol��L��1��c(SO42��)=0.04mol��L��1��Ksp(BaSO4)=1.1��10��10��Ksp( BaMoO4)=4.0��10��8������Ba(OH)2�����������Һ����仯�ɺ��ԡ�]
(5)��ͼ��̼�������ᡢ�����������-�¹��������Ỻ�ͼ�3�ֲ�ͬ�����и�ʴ���ʵ�ʵ������

��̼��������������и�ʴ���������Ũ�ȱ仯�����Բ��죬��ԭ�������___________��
�ڿ����л��ͼ���̼�ֵĻ�ʴԭ�����ڸ��������γ� FeMoO4-Fe2O3����Ĥ���ܱ�ʽѭ����ȴˮϵͳ�е�̼�ֹܵ���ʴ������뻺�ͼ�������NaNO2��NaNO2��������________��
���𰸡�+6�� �ؽᾧ MoO3��SO2 MoO3 + CO32- = MoO42- + CO2�� ���ֲ�Ʒ������ʵ������¶� 97.25 Cl-������̼�ֵĸ�ʴ��SO42-������̼�ֵĸ�ʴ��ʹ��̼���������еĸ�ʴ�������Կ������������Һ����Ũ�ȵ�������������ǿ����ʹ�����ۻ�����ʴ���ʼ��� �������������������������
��������
�����⾫��MoS2ȼ�գ���Ӧ����ʽΪMoS2 + O2![]() MoO3 + SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ���ӷ���ʽΪMoO3 + CO32- = MoO42- + CO2����Ȼ������Һ�м����������ȥ�ؽ������ӣ���Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ��Ȼ���ؽᾧ�õ������ƾ���(Na2MoO4��2H2O)���ݴ˷�����
MoO3 + SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ���ӷ���ʽΪMoO3 + CO32- = MoO42- + CO2����Ȼ������Һ�м����������ȥ�ؽ������ӣ���Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ��Ȼ���ؽᾧ�õ������ƾ���(Na2MoO4��2H2O)���ݴ˷�����
(1)Na2MoO42H2O����Ԫ�ػ��ϼ�+1�ۣ���Ԫ�ػ��ϼ�- 2�ۣ�2�� (+1)+x+ (-2)��4=0������õ���Ԫ�صĻ��ϼ���+6�ۣ��ᾧ�õ��������ƾ����Ǵֲ�Ʒ��Ҫ�õ������������ƾ��壬��һ����Ҫ���еIJ������ؽᾧ��
(2)MoS2 + O2![]() MoO3 + SO2��Ӧ����Ԫ�ػ��ϼ�0�۱仯Ϊ-2�ۣ���Ԫ�ػ��ϼ�����Ϊ+4�ۣ���Ԫ�ػ��ϼ�����Ϊ+6�ۣ�Ԫ�ػ��ϼ����߱��������÷�Ӧ������������MoO3��SO2��
MoO3 + SO2��Ӧ����Ԫ�ػ��ϼ�0�۱仯Ϊ-2�ۣ���Ԫ�ػ��ϼ�����Ϊ+4�ۣ���Ԫ�ػ��ϼ�����Ϊ+6�ۣ�Ԫ�ػ��ϼ����߱��������÷�Ӧ������������MoO3��SO2��
(3) �������ʱ����Na2CO3��Һ��MoO3��Ӧ���ɶ�����̼��Na2MoO4����Ӧ�����ӷ���ʽΪ��MoO3 + CO32- = MoO42- + CO2��������߸÷�Ӧ���ʵĴ�ʩ�У����ֲ�Ʒ��������Ӵ�����ܼӿ췴Ӧ���ʣ��ʵ�����̼������Һ��Ũ�ȷ�Ӧ���ʼӿ죻�ʵ������¶ȼӿ췴Ӧ���ʣ��ʴ�Ϊ���ֲ�Ʒ������ʵ�����̼������Һ��Ũ�Ȼ��ʵ������¶ȣ�
(4) Ksp( BaMoO4)=4.0��10��8����������Һ��c(MoO42��)=0.40mol��L��1��BaMoO4��ʼ����ʱ����Һ�б����ӵ�Ũ��Ϊ��c(Ba2+ )=![]() 1��10-7 mol/L��Ksp(BaSO4)=1.1��10��10����Һ����������ӵ�Ũ��Ϊ��c(SO42��)=
1��10-7 mol/L��Ksp(BaSO4)=1.1��10��10����Һ����������ӵ�Ũ��Ϊ��c(SO42��)=![]() ��ԭ��Һ��c(SO42��)=0.04mol��L��1����������ӵ�ȥ����Ϊ��
��ԭ��Һ��c(SO42��)=0.04mol��L��1����������ӵ�ȥ����Ϊ��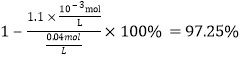 ��
��
(5)����ͼʾ���ݿ�֪��̼���������еĸ�ʴ�������Կ�������ĸ�ʴ�ٶȣ���˿��ܵ�ԭ����Cl-������̼�ֵĸ�ʴ��SO42-������̼�ֵĸ�ʴ��ʹ��̼���������еĸ�ʴ�������Կ����������Ũ��������Ũ��������˶ۻ�����ʴ�ٶȺ������ʴ�Ϊ�� Cl-������̼�ֵĸ�ʴ��SO42-������̼�ֵĸ�ʴ(��������Һ����Ũ�ȵ�������������ǿ����ʹ�����ۻ�����ʴ���ʼ���)��
��NaNO2���������ԣ��ܹ��ڸ��������γ�FeMoO4-Fe2O3����Ĥ���ʴ�Ϊ��������������������������á�

����Ŀ����.����ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�������֪������ݣ�25�棩��
��ѧʽ | ����ƽ�ⳣ�� |
HCN | K=4.9��10-10 |
CH3COOH | K=1.8��10-5 |
H2CO3 | K1=4.4��10-7��K2=4.7��10-11 |
��1��25��ʱ���������ʵ���Ũ����ͬ��������Һ��pH�ɴ�С��˳��Ϊ_____������ţ�
a��NaCN��Һ b��Na2CO3��Һ c��CH3COONa��Һ d��NaHCO3��Һ
��2��25��ʱ����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ____________��
��. ������������NaOH ��H2SO4 ��CH3COOH ��NaCl ��CH3COONa
��(NH4)2SO4 ��CH3COONH4 ��NH4HSO4 ��NH3H2O ��NH4Cl����ش��������⣺
��1�������£���pH��Ϊ11�ҵ������NaOH��NH3H2O�ֱ��ˮϡ��m����n����ϡ�ͺ�������Һ��pH�����9���� m___________ n ���� ��<������>����=������
��2����֪ˮ��������ƽ�⣺H2O![]() H++OH- H>0������ʹƽ�������ƶ�����������Һ�����ԣ�ѡ������з�����____________��
H++OH- H>0������ʹƽ�������ƶ�����������Һ�����ԣ�ѡ������з�����____________��
A. ��ˮ�м���NaHSO4���� B. ��ˮ�м�NaHCO3����
C. ������100��[����c(H+) = 1��10-6 molL-1] D. ��ˮ�м���NH4Cl����
��3�����ʵ���Ũ����ͬ�Ģ١��ڡ��ۡ��ܡ��ݡ�������ϡ��Һ�У�ˮ�����OH-Ũ���ɴ�С��˳��Ϊ(�����)__________________��
��4�����ʵ���Ũ����ͬ�Ģޡ��ߡ��ࡢ�ᡢ������ϡ��Һ�У�NH4+Ũ���ɴ�С��˳����(�����)___________________��
����Ŀ���������������������������������ӦΪ��2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ� ��
N2O5(g)+O2(g)����Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ� ��
A | B | C | D |
|
|
|
|
�����¶ȣ� | 0��3s�ڣ���Ӧ����Ϊ�� | t1ʱ����������� | ��ƽ��ʱ�����ı�x����xΪc(O2) |
����Ŀ������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ�������й㷺��Ӧ�á�
��1����һ���¶��£��ڹ̶�������ܱ������н��п��淴ӦN2��3H2![]() 2NH3���ÿ��淴Ӧ�ﵽƽ��ı�־��________��
2NH3���ÿ��淴Ӧ�ﵽƽ��ı�־��________��
A��3v��(H2)��2v��(NH3)
B����λʱ������m mol N2��ͬʱ����3m mol H2
C�������ڵ���ѹǿ������ʱ����仯
D�����������ܶȲ�����ʱ��仯
��2����ҵ�Ͽ�����Ȼ��Ϊԭ������ȡ�ϳɰ���ԭ����������ij�о���ѧϰС���ͬѧģ�ҵ��ȡ������ԭ������һ���¶��£����Ϊ2 L�ĺ����ܱ������У�������±���ʾ���ݡ�
ʱ��/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
��ش��������⣺
�ٸ��¶��£�������Ӧ��ƽ�ⳣ��K��________��
�ڷ�Ӧ��7��10 min�ڣ�CO�����ʵ������ٵ�ԭ�������________(����ĸ)��
A������CH4�����ʵ��� ���� B�������¶�
C�������¶� ���� D������H2
����������ͬ���¶ȣ���2 L�ĺ����ܱ�������ͬʱ����0.2 mol CH4��0.6 mol H2O��a mol CO��0.5 mol H2����a��0.2ʱ��������Ӧ��________(�����Ӧ�����淴Ӧ��)������С���Ҫʹ������Ӧ��ʼʱ���淴Ӧ������У���a��ȡֵ��ΧΪ________����֪��0.253=0.0156��





