题目内容
【题目】化学上常用AG表示溶液中的酸碱度, 。
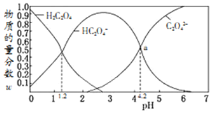
。![]() 时
时 用
用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 的
的![]() 溶液,AG与所加NaOH溶液的体积
溶液,AG与所加NaOH溶液的体积![]() 的关系如图所示,下列说法不正确的是
的关系如图所示,下列说法不正确的是![]()

A.随着NaOH溶液的加入, 增大
增大
B.![]() 时,
时,![]() 的电离常数
的电离常数![]()
C.b点溶液中存在![]()
D.a、b、c、d、e五点的溶液中,水的电离程度最大的点是d
【答案】A
【解析】
A.用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 的
的![]() 溶液,随氢氧化钠加入氢离子浓度减小,亚硝酸根离子浓度增大,
溶液,随氢氧化钠加入氢离子浓度减小,亚硝酸根离子浓度增大,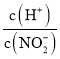 减小,选项A错误;
减小,选项A错误;
B.a点 ,则
,则 ,Kw
,Kw![]() ,所以
,所以![]() ,
,![]() 的电离常数
的电离常数 ,选项B正确;
,选项B正确;
C.b点溶液为等浓度的![]() 和
和![]() 溶液,溶液中存在电荷守恒:
溶液,溶液中存在电荷守恒:![]() ,物料守恒:
,物料守恒:![]() ,将
,将![]() 得:
得:![]() ,选项C正确;
,选项C正确;
D.用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 的
的![]() 溶液,加入氢氧化钠溶液20mL恰好完全反应生成亚硝酸钠,溶液中亚硝酸根离子水解溶液显碱性,促进水的电离,a、b、c点酸过量,e点氢氧化钠过量对水的电离起到抑制作用,选项D正确;
溶液,加入氢氧化钠溶液20mL恰好完全反应生成亚硝酸钠,溶液中亚硝酸根离子水解溶液显碱性,促进水的电离,a、b、c点酸过量,e点氢氧化钠过量对水的电离起到抑制作用,选项D正确;
答案选A。

【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视