题目内容
【题目】![]() ,向20mL
,向20mL![]() 的
的![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液
的NaOH溶液![]() 滴定过程中溶液温度保持不变
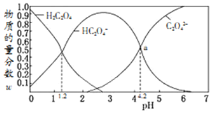
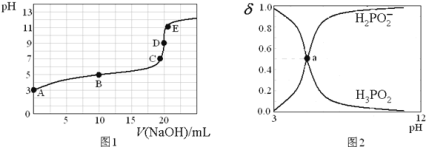
滴定过程中溶液温度保持不变![]() ,滴定曲线如图1,含磷物种浓度所占分数
,滴定曲线如图1,含磷物种浓度所占分数![]() 随pH变化关系如图2,则下列说法不正确的是
随pH变化关系如图2,则下列说法不正确的是![]()
A.![]() 的电离方程式为:
的电离方程式为:![]() ;电离常数
;电离常数![]()
B.B点溶液中存在关系:![]()
C.图2中的a点对应为图1中的B点
D.D点时,溶液中微粒浓度大小关系为:![]()
【答案】C
【解析】
A、根据图2所示,一定pH下,电离出的离子为![]() ,所以
,所以![]() 是一元弱酸,电离方程式为:
是一元弱酸,电离方程式为:![]() ;20mL
;20mL![]() 的
的![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液10mL,得到等浓度的
的NaOH溶液10mL,得到等浓度的![]() 和
和![]() ,此时即为B点,
,此时即为B点,![]() ,根据电离平衡常数Ka
,根据电离平衡常数Ka![]() ,选项A正确;
,选项A正确;
B、B点溶液为等浓度的![]() 和
和![]() ,存在电荷守恒关系:
,存在电荷守恒关系:![]() ,存在物料守恒:
,存在物料守恒:![]() ,
,![]() 整理得到
整理得到![]() ,选项B正确;
,选项B正确;
C、B点溶液为等浓度的![]() 和
和![]() ,显酸性,
,显酸性,![]() 的电离大于
的电离大于![]() 的水解,所以
的水解,所以![]() ,选项C错误;
,选项C错误;
D、D点是20mL![]() 的
的![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液20mL,恰好完全反应,得到的是
的NaOH溶液20mL,恰好完全反应,得到的是![]() ,溶液显示碱性,所以
,溶液显示碱性,所以![]() ,选项D正确。
,选项D正确。
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】某同学用中和滴定法测定某烧碱样品的纯度。实验步骤如下:
Ⅰ.配制待测液:用托盘天平称量5.0g烧碱样品(杂质不与盐酸反应),配制成1000mL溶液。
Ⅱ.滴定:取20.00mL所配待测液用0.10mol/L的盐酸标准液进行滴定,达到滴定终点后重复此操作两次。
Ⅲ.记录数据如下:
测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 20.00 | 0.50 | 20.64 |
2 | 20.00 | 1.20 | 24.32 |
3 | 20.00 | 1.30 | 21.40 |
请根据上述实验回答以下问题:
(1)配制待测液时,除烧杯和玻璃棒外,还需要用到的主要玻璃仪器有_____。
(2)盛装0.10mol/L的盐酸标准液应该使用____滴定管(选填“酸式”或“碱式”),滴定时眼睛应注意观察_____。
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果_____;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果____;
③读数时,滴定前俯视,滴定后仰视,测定结果_____。
(4)计算纯度:烧碱样品的纯度是_____(保留一位小数)。
【题目】下列说法正确的是( )
选项 | 实验目的 | 所选主要仪器 | 部分操作 |
A | 用浓硫酸配制480mL0.1molL-1硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸倒入容量瓶中,加水溶解至刻度线 |
B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、球形冷凝管、锥形瓶、牛角管 | 控制温度分别收集甲醇和甘油 |
D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
A.AB.BC.CD.D