题目内容
【题目】氢能是重要的新能源,储氢技术的开发对于氢能源的推广应用是一个非常关键的技术。其中有一种方法是借助有机物储氢,其装置如图所示(忽略其它有机物,且涉及到有机物均为气体),回答下列问题:
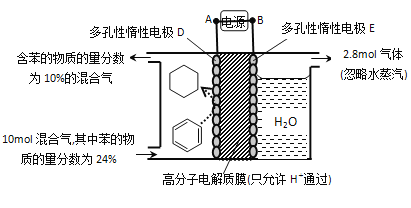
(1)该电池中A的电极名称为______
(2)写出D极生成目标产物的电极反应式______
(3)D极收集到新生成的气体有______;通过此方法储氢后,共收集到混合气体的物质的量为______
(4)该储氢装置的电流效率为______(计算结果保留三位有限数字。已知:电流效率=生成目标产物消耗的电子数/转移的电子总数×100%)
【答案】负极 C6H6+6H++6e-=C6H12 H2、环己烷(C6H12) 12mol 64.3%
【解析】
(1)根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极;
(2)该实验的目的是储氢,所以阴极D上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
(3)阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,阴极(D极)的电极反应式为C6H6+6H++6e-=C6H12、2H++2 e-=H2↑,据此分析;
(4)阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η。
(1)根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,故答案为:负极;
(2)该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12;
(3)D极收集到新生成的气体有H2、C6H12;
阳极(E极)的电极反应式为4OH- -4e-=O2↑+2H2O,生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,阴极(D极)的电极反应式为C6H6+6H++6e-=C6H12、2H++2 e-=H2↑,设参加反应的C6H6、生成H2的物质的量分别为x、y,根据图中信息及电子得失守恒,可得6x+2y=11.2mol;由于苯转化为环己烷时总物质的量不变,故收集到混合气体的物质的量为(10mol+y),则![]() =10%,将两式联立方程组,解得x=1.2mol、y=2mol,因此,通过此方法储氢后,共收集到混合气体的物质的量为10mol+2mol=12mol;
=10%,将两式联立方程组,解得x=1.2mol、y=2mol,因此,通过此方法储氢后,共收集到混合气体的物质的量为10mol+2mol=12mol;
(4)该储氢装置的电流效率η=![]() =64.3%。
=64.3%。