题目内容
已知:HCN(aq)与NaOH(aq)反应的△H=" -12.1kJ" /mol;HCl(aq)与NaOH(aq)反应的△H =" -55.6kJ/" mol。则HCN在水溶液中电离的ΔH等于
| A.-67.7 kJ /mol | B.-43.5kJ /mol |
| C.+43.5 kJ/ mol | D.+67.7 kJ/ mol |
C
解析

下列反应前后物质的总能量变化能用下图表示的是( )
| A.生石灰和水的反应 |
| B.石灰石在高温下的分解反应 |
| C.盐酸与氢氧化钠溶液的反应 |
| D.木炭在氧气中燃烧 |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程中正确的是
A.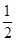 N2H4(g)+ N2H4(g)+ 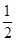 O2(g)= 1/2 N2(g)+ H2O(l)△H=+257kJ·mol-1 O2(g)= 1/2 N2(g)+ H2O(l)△H=+257kJ·mol-1 |
| B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ·mol-1 |
| C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ·mol-1 |
| D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ·mol-1 |
已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同且恒容的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是( )
| A.Q1=2Q2=92.4 | B.92.4 >Ql>2Q2 | C.92.4=Q1>2Q2 | D.92.4 >Q1=2Q2 |
下列变化属于吸热反应的是 ( )
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥Ba(OH)2·8H2O与NH4Cl晶体混合
| A.①④⑤ | B.①②④ | C.①②⑥ | D.②④⑥ |
烷烃分子中去掉2个氢原子形成一个双键是吸热反应,1,3—环己二烯失去2个氢原子生成苯是放热反应。下列说法正确的是
| A.1,3—环己二烯加氢是吸热反应 | B.1,3—环己二烯比苯稳定 |
| C.苯比1,3—环己二烯稳定 | D.苯加氢生成环己烷是吸热反应 |
已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)= Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) = CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
| A.该反应的ΔH=+91 kJ·mol-1 |
| B.加入催化剂,该反应的ΔH变小 |
| C.反应物的总能量大于生成物的总能量 |
| D.如果该反应生成液态CH3OH,则ΔH增大 |
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。下列有关说法正确的是( )
| A.氢制备工艺廉价易行,且储存方便 |
| B.燃料电池车中能量转化率为100% |
| C.燃料电池车是直接将化学能转化为电能 |
| D.利用热电厂的电能电解蒸馏水制备氢气是一种环保之举 |