题目内容
已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同且恒容的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是( )
| A.Q1=2Q2=92.4 | B.92.4 >Ql>2Q2 | C.92.4=Q1>2Q2 | D.92.4 >Q1=2Q2 |
B
解析试题分析:由题意可得热化学方程式:N2(气)+3H2(气)  2 NH3(气) ΔH=-92.4 kJ/mol . ①向密闭容器甲中通入1 molN2和3 mol H2,由于该反应是可逆反应,反应物不可能完全转化为生成物,所以达到平衡时放出热量Q1kJ<92.4 kJ÷2。②由于反应是在容积相同且恒容的密闭容器中进行。若平衡不发生移动,由于物质的量为①的一半,放出的热量也是原来的一半。但是由于该反应的正反应是气体体积减小的反应。物质的量减少,压强减小,根据平衡移动原理:减小压强,化学平衡向逆反应方向移动,所以放出的热量要比一半少。因此热量关系为92.4 >Ql>2Q2。故选项为B。
2 NH3(气) ΔH=-92.4 kJ/mol . ①向密闭容器甲中通入1 molN2和3 mol H2,由于该反应是可逆反应,反应物不可能完全转化为生成物,所以达到平衡时放出热量Q1kJ<92.4 kJ÷2。②由于反应是在容积相同且恒容的密闭容器中进行。若平衡不发生移动,由于物质的量为①的一半,放出的热量也是原来的一半。但是由于该反应的正反应是气体体积减小的反应。物质的量减少,压强减小,根据平衡移动原理:减小压强,化学平衡向逆反应方向移动,所以放出的热量要比一半少。因此热量关系为92.4 >Ql>2Q2。故选项为B。
考点:考查可逆反应的特征及压强对化学平衡移动的影响的知识。

强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O ( l ) ΔH=-57.3 kJ / mol
分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时反应热分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是
| A.ΔH1>ΔH3>ΔH2 | B.ΔH1<ΔH2<ΔH3 |
| C.ΔH1=ΔH2=ΔH3 | D.ΔH1<ΔH3<ΔH2 |
对于反应中的能量变化,表述正确的是
| A.断开化学键的过程会放出能量 |
| B.放热反应中,反应物的总能量大于生成物的总能量 |
| C.加热才能发生的反应一定是吸热反应 |
| D.氧化反应均为吸热反应 |
下列依据热化学方程式得出的结论正确的是( )
| A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| B.已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol--1,则氢气的燃烧热为241.8 kJ·mol-1 |
| C.已知2C(s)+2O2(g)=2CO2(g)△H=a、2C(s)+O2(g)=2CO(g)△H=b,则a>b |
| D.已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
“地沟油”被称为“生物燃料”,该燃料属于生物质能。已知生物质的主要转化途径及主要产物如下图所示。则下列关于生物燃料以及生物质能的说法中正确的是( )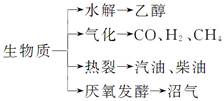
①生物燃料本质上能量来源于太阳能 ②由纤维素水解获得的乙醇属于生物质能 ③生物质裂解获得的汽油、柴油等属于纯净物 ④由植物秸秆等发酵获得的沼气,主要成分是甲烷 ⑤生物质资源是一种污染小的可再生能源
| A.①②③④⑤ | B.①②④⑤ |
| C.③④⑤ | D.①②③④ |
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1,则氢气的燃烧热(△H)为-241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ·mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 |
| C.己知2C(s)+2O2(g)=2CO2(g)△H = a;2C(s)+O2(g)=2CO(g);△H= b,则a>b |
| D.已知C (石墨,s)="C" (金刚石,s) △H>0,则金刚石比石墨稳定 |
已知:HCN(aq)与NaOH(aq)反应的△H=" -12.1kJ" /mol;HCl(aq)与NaOH(aq)反应的△H =" -55.6kJ/" mol。则HCN在水溶液中电离的ΔH等于
| A.-67.7 kJ /mol | B.-43.5kJ /mol |
| C.+43.5 kJ/ mol | D.+67.7 kJ/ mol |