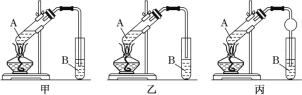
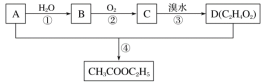
题目内容
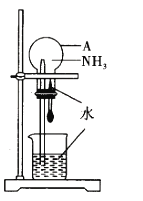
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。试回答下列问题:
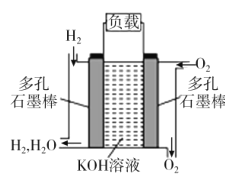
(1)写出氢氧燃料电池工作时的正极反应式:___。
(2)该氢氧燃料电池每转移0.1mo1电子,消耗标准状态下___L氧气。
【答案】2H2O+O2+4e-=4OH- 0.56
【解析】
通常在燃料电池反应中,O2得电子,所以通O2的电极为正极,在碱性电解质溶液中,O2得电子的产物与溶液反应生成OH-,电极反应式为O2+4e-+2H2O=4OH-;通H2的电极为负极,H2失电子的产物与电解质溶液反应生成H2O,电极反应式为H2-2e-+2OH-=2H2O,据此分析解答。
(1)根据上述分析可知,通O2的电极为正极,在碱性电解质溶液中,O2得电子的产物与溶液反应生成OH-,电极反应式为O2+4e-+2H2O=4OH-;
(2)该氢氧燃料电池中,在正极:O2~4e-,若电池工作时转移0.1mol电子,理论上消耗标准状态下O2的体积为![]() 。
。

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目