题目内容
【题目】磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XKJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是________。
(2)已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:________。
【答案】P2O3、P2O5P(s)+![]() O2(g)=
O2(g)=![]() P2O3(s)△H=﹣(20X﹣Y)kJ/mol
P2O3(s)△H=﹣(20X﹣Y)kJ/mol
【解析】
(1)根据氧化还原反应中得失电子数相等判断其产物;(2)先写出磷的燃烧热化学反应方程式和.1g的单质磷(P)在3.2g的氧气中燃烧的热化学反应方程式,将方程式进行整理得出磷燃烧生成三氧化二磷的热化学反应方程式,其焓变相应改变。
(1)磷在氧气中燃烧是氧化还原反应,3.2g氧气参加反应得到电子的物质的量=![]() =0.4mol;假设生成的固体是三氧化二磷,磷失去电子的物质的量=
=0.4mol;假设生成的固体是三氧化二磷,磷失去电子的物质的量=![]() ×3=0.3mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;假设生成的固体是五氧化二磷,磷失去电子的物质的量=
×3=0.3mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;假设生成的固体是五氧化二磷,磷失去电子的物质的量=![]() ×5=0.5mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;失去的电子数应该在二者之间,所以生成的固体是两种固体的混合物,即P2O3、P2O5,故答案为:P2O3、P2O5;(2)磷燃烧的热化学方程式为:P(s)+
×5=0.5mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;失去的电子数应该在二者之间,所以生成的固体是两种固体的混合物,即P2O3、P2O5,故答案为:P2O3、P2O5;(2)磷燃烧的热化学方程式为:P(s)+![]() O2(g)=
O2(g)=![]() P2O5 (s)△H=﹣Y kJ/mol①,3.1g的单质磷(P)在3.2g的氧气中燃烧生成三氧化二磷和五氧化二磷的热化学反应方程式为:4P(s)+4O2(g)=P2O5(s)+P2O3(s)△H=﹣40X KJ/mol②,将方程式
P2O5 (s)△H=﹣Y kJ/mol①,3.1g的单质磷(P)在3.2g的氧气中燃烧生成三氧化二磷和五氧化二磷的热化学反应方程式为:4P(s)+4O2(g)=P2O5(s)+P2O3(s)△H=﹣40X KJ/mol②,将方程式![]() 得P(s)+
得P(s)+![]() O2(g)=
O2(g)=![]() P2O3(s)△H=﹣(20X﹣Y)KJ/mol,故答案为:P(s)+
P2O3(s)△H=﹣(20X﹣Y)KJ/mol,故答案为:P(s)+![]() O2(g)=
O2(g)=![]() P2O3(s)△H=﹣(20X﹣Y)kJ/mol。
P2O3(s)△H=﹣(20X﹣Y)kJ/mol。

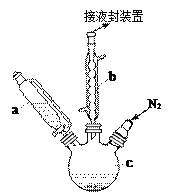
【题目】下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见下表。
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是_____(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)己知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式:________________。
(3)仪器B的名称是________,冷却水应从B的____(填“上“或“下")口流进。
(4)反应生成的溴乙烷应在______(填“A"或"C")中。
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列_____(填字母)溶液来洗涤产品。
a氢氧化钠 b.碘化亚铁 c.亚硫酸钠 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有_______________。
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g)![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/mol·L-1 | c(I2)/mol·L-1 | c(HI)/mol·L-1 | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | —— |
下列判断正确的是
A. H2的平衡浓度:a=b>0.004 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率等于20% D. 丙中条件下,该反应的平衡常数K=4