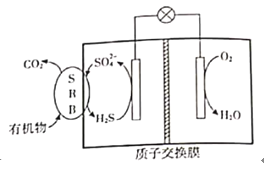
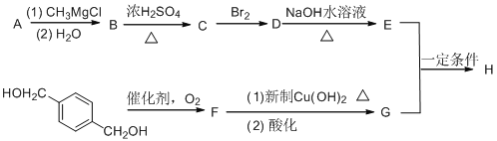
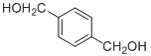
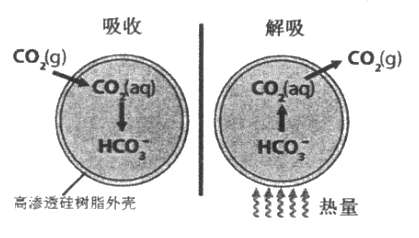
题目内容
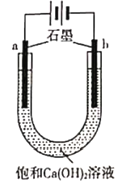
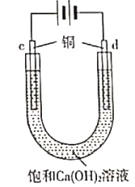
【题目】某实验小组在常温下进行电解饱和Ca(OH)2溶液的实验,实验装置与现象见下表。
序号 | I | II |
装置 |
|
|
现象 | 两极均产生大量气泡,b极比a极多;a极溶液逐渐产生白色浑浊,该白色浑浊加入盐酸有气泡产生 | 两极均产生大量气泡,d极比c极多;c极表面产生少量黑色固体;c极溶液未见白色浑浊 |
下列关于实验现象的解释与推论,正确的是( )
A. a极溶液产生白色浑浊的主要原因是电解过程消耗水,析出Ca(OH)2固体
B. b极产生气泡:4OH- -4e- === O2↑ +2H2O
C. c极表面变黑:Cu -2e- +2OH- === CuO +H2O
D. d极电极反应的发生,抑制了水的电离
【答案】C
【解析】
A、a极为电解池的阳极,氢氢根离子放电生成氧气与电极C反应生成二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙,该白色浑浊为碳酸钙,加入盐酸有二氧化碳产生,而不是析出Ca(OH)2固体,故A错误;
B、b极是阴极,水电离产生的氢离子放电生成氢气,而不是氢氧根离子放电,生成氧气,故B错误;
C、c极为阳极,表面产生少量黑色固体,是铜放电生成的氧化铜,所以c极表面变黑:Cu-2e-+2OH-═CuO+H2O,故C正确;
D、d极为阴极,是水电离产生的氢离子放电生成氢气,促进了水的电离,故D错误;
答案选C。

练习册系列答案
相关题目