题目内容
【题目】在2L密闭容器中,充入10 mol N2和22mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡时N2的转化率为60%,求:
(1)平衡时v (NH3) 的速率__________。
(2)求该温度下的平衡常数K(列出算式,算出结果)________。
(3)H2在平衡混合气体中的体积分数(即物质的量分数)________。
(4)平衡时容器的压强与起始时压强之比(即物质的量之比)________。
【答案】3 mol/(L·min) ![]() (mol/L)-2或2.25或
(mol/L)-2或2.25或![]() 20% 5:8
20% 5:8
【解析】
2min时达到平衡,测得平衡时N2的转化率为60%,则转化的氮气为10mol×60%=6mol,结合三段式分析解答。
2min时达到平衡,测得平衡时N2的转化率为40%,则转化的氮气为10mol×60%=6mol,则
N2(g)+3H2(g)2NH3(g)
起始(mol): 10 220
转化(mol): 6 18 12
平衡(mol): 4 4 12
(1)平衡时v(NH3)的速率为![]() =3mol/(Lmin),故答案为:3mol/(Lmin);
=3mol/(Lmin),故答案为:3mol/(Lmin);
(2)化学平衡常数等于生成物浓度的幂之积和反应物浓度的幂之积的比值,该反应的平衡常数K=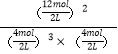 =
=![]() (mol/L)-2,故答案为:
(mol/L)-2,故答案为:![]() (mol/L)-2;
(mol/L)-2;
(3)H2的体积分数=物质的量分数=![]() ×100%=20%,故答案为:20%;
×100%=20%,故答案为:20%;
(4)相同条件下,压强之比等于物质的量之比,P后∶P前=n后∶n前=(4+4+12)mol∶(10+22)mol=5∶8,故答案为:5∶8。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某实验小组在常温下进行电解饱和Ca(OH)2溶液的实验,实验装置与现象见下表。
序号 | I | II |
装置 |
|
|
现象 | 两极均产生大量气泡,b极比a极多;a极溶液逐渐产生白色浑浊,该白色浑浊加入盐酸有气泡产生 | 两极均产生大量气泡,d极比c极多;c极表面产生少量黑色固体;c极溶液未见白色浑浊 |
下列关于实验现象的解释与推论,正确的是( )
A. a极溶液产生白色浑浊的主要原因是电解过程消耗水,析出Ca(OH)2固体
B. b极产生气泡:4OH- -4e- === O2↑ +2H2O
C. c极表面变黑:Cu -2e- +2OH- === CuO +H2O
D. d极电极反应的发生,抑制了水的电离




