题目内容
【题目】
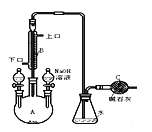
(1)欲从苯酚的乙醇溶液中回收苯酚,有下列操作,合理的顺序是 (填字母)。
①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤通入过量CO2
⑥加入足量NaOH 溶液 ⑦加入足量FeCl3溶液 ⑧加入足量浓溴水
A. ⑧ ② B.⑥ ① ⑤ ③ C.④② D.⑦ ① ③
(2)下列说法正确的是 (填序号)。
①麦芽糖及其水解产物均能发生银镜反应,且试管内壁的银镜需用稀氨水洗涤
②蛋白质溶液中加入饱和硫酸铵溶液,有沉淀析出,加水后沉淀也不溶解
③淀粉液中加入几滴稀硫酸加热几分钟,冷却后加入银氨溶液并水浴加热,没有观察到银镜现象,证明淀粉未发生水解
④只用溴水就能鉴别四氯化碳、甲苯、乙烯、乙醇
Ⅱ已知:CH3CH2OH+NaBr+H2SO4(浓) ![]() CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置如图:圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
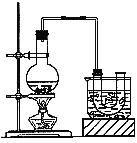
(1)反应时若温度过高会降低溴乙烷的产率,原因是 ;也可看到有红棕色气体产生,该气体的化学式为 。为避免温度过高,宜采用 加热。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去其中的杂质,最好选用下列试剂中的
(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
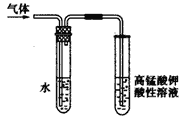
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用右图所示装置进行实验:该实验的目的是 。 盛水的试管(装置)的作用是 。
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后 (填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为 (保留两位有效数字)。
【答案】Ⅰ.(1) B (2) ④ Ⅱ.(10分)(1)溴乙烷的沸点低易挥发 Br2 水浴
(2)A (3)验证生成的气体是乙烯 ( 或验证溴乙烷与NaOH发生消去反应的产物 )
除去挥发出来的乙醇蒸气 (4)④①⑤③② (5)70%
【解析】
试题分析:Ⅰ.苯酚和乙醇的沸点相差很小,直接用蒸馏的方法很难将其分开.应先加NaOH将苯酚转化为苯酚钠,苯酚钠是盐类物质,沸点和乙醇相差很大,因此控制温度可以用蒸馏法把乙醇排出,剩余的苯酚钠溶液中通入足量CO2,可以析出溶解度很小的苯酚,此时苯酚以乳浊液形式存在,待静止分层后再进行分液操作便可得到苯酚,答案选B。
(2)①麦芽糖及其水解产物均能发生银镜反应,试管内壁的银镜不能稀氨水洗涤,应该用硝酸,①错误;②蛋白质溶液中加入饱和硫酸铵溶液,发生盐析,加水后沉淀能溶解,②错误;③淀粉液中加入几滴稀硫酸加热几分钟,冷却后需要首先加碱液中和硫酸,然后再加入银氨溶液并水浴加热,③错误;④四氯化碳萃取溴水中的溴,有机层在下层;甲苯也萃取溴水中的溴,但有机层在上层;乙烯和溴水发生加成反应;乙醇和溴水互溶,因此只用溴水就能鉴别四氯化碳、甲苯、乙烯、乙醇,④正确,答案选④;
Ⅱ.(1)由于溴乙烷的沸点低易挥发,所以反应时若温度过高会降低溴乙烷的产率;又由于浓硫酸具有强氧化性,能氧化Br﹣,会有溴生成,化学式为Br2;又因为温度低于100℃,因此可以利用水浴加热来控制反应温度;
(2)由于溴乙烷密度大于水的密度,故溴乙烷应该在下层;粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则A.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,A正确;B.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,B错误;C.氢氧化钠溶液显示碱性,可以除去杂质溴,但溴乙烷也会在此溶液里发生水解反应,C错误;D.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,D错误;答案选A。
(3)溴乙烷发生消去反应生成乙烯,发生水解反应生成乙醇,则根据装置图可知实验目的是验证生成的气体是乙烯 ( 或验证溴乙烷与NaOH发生消去反应的产物 )。由于乙醇易挥发,乙醇也能使酸性高锰酸钾溶液褪色,则盛水的试管(装置)的作用是除去挥发出来的乙醇蒸气;
(4)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤③②
(5)乙醇的物质的量是![]() ,溴化钠的物质的量是10.3g÷103g/mol=0.1mol,所以理论上可以产生0.1mol溴乙烷,质量是0.1mol×109g/mol=10.9g,则产率是
,溴化钠的物质的量是10.3g÷103g/mol=0.1mol,所以理论上可以产生0.1mol溴乙烷,质量是0.1mol×109g/mol=10.9g,则产率是![]() 。
。