题目内容
【题目】氨、烧碱在工农业生产和工业废水处理中具有广泛用途。回答下列问题:
(1)工业上制取硝酸的第一步是以氨和空气为原料,用铂一铑合金网为催化剂,在氧化炉中(温度为800℃)进行氨催化氧化反应。该反应的氧化产物为____________(填名称)。
(2)某工业废水中含有2Mg2+、Cu2+等离子。取一定量的该工业废水,向其中滴加烧碱溶液,当Mg(OH)2开始沉淀时,溶液中![]() 为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
(3)已知反应N2(g)+3H2(g)![]() 2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
(4)Fritz Haber 研究了下列反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:

①在0~10min内,平均反应速率v(NH3)= ___________。
②在10~20min内,各物质浓度变化的原因可能是_________(填“加了催化剂”或“降低温度”),其判断理由是________________。
③温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化,反应是否达到了化学平衡状态?___________(填“是”或“否”)其判断理由是_________________。
④500℃时,该反应的平衡常数K的计算式为_________(不需要算出结果,) NH3的体积分数是_________(保留两位小数)。
【答案】
(1)一氧化氮;(2)1.2×10-9;(3)1172.4;
(4)①0.005mol/(L·min);②加了催化剂;③是;合成氨的反应是气体分子数减少的反应,当容积一定时,总压强不再变化;④![]() ;0.46。
;0.46。
【解析】
试题分析:(1)氨和空气中的氧气反应生成一氧化氮和水,反应中N元素的化合价由-3价变成+2价,因此氧化产物为NO,故答案为:NO;
(2)某工业废水中含有Mg2+、Cu2+等离子,向其中滴加烧碱溶液,当Mg(OH)2开始沉淀时,溶液中![]() =
=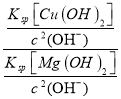 =
=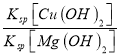 =
=![]() = 1.2×10-9,故答案为:1.2×10-9;
= 1.2×10-9,故答案为:1.2×10-9;
(3)设1mol NH3(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-944.6kJ-436kJ×3=92.2kJ,解得x=1172.4,故答案为:1172.4;
(4)①根据反应速率v(NH3)=![]() =
= =0.005mol/(L.min),故答案为:0.005mol/(L.min);②由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2) = 0.025mol × 4=0.1mol ,△n(H2) = 0.025mol × 12 = 0.3mol ,△n(NH3) = 0.025mol × 8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大,降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合,故答案为:加了催化剂;三种气体物质的速率增加倍数相同;
=0.005mol/(L.min),故答案为:0.005mol/(L.min);②由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2) = 0.025mol × 4=0.1mol ,△n(H2) = 0.025mol × 12 = 0.3mol ,△n(NH3) = 0.025mol × 8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大,降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合,故答案为:加了催化剂;三种气体物质的速率增加倍数相同;
③该反应属于气体的物质的量变化的反应,温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化,说明反应达到了化学平衡状态,故答案为:是;合成氨的反应是气体分子数减少的反应,当容积一定时,总压强不再变化;
④化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,由图象可知,20min达平衡时,n(N2)=0.025mol×10=0.25mol,n(H2)=0.025mol×6=0.15mol,n(NH3)=0.025mol×12=0.3mol,所以所以其平衡常数K=![]() =
=![]() ;第2次平衡时NH3的体积分数=
;第2次平衡时NH3的体积分数=![]() ×100%=45.5%,故答案为:
×100%=45.5%,故答案为:![]() ;0.46。
;0.46。

 阅读快车系列答案
阅读快车系列答案