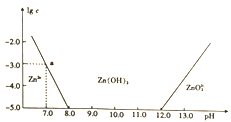
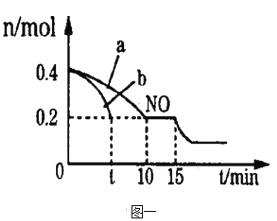
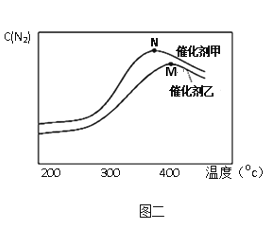
题目内容
【题目】最近有研究人员发现了一种处理高浓度乙醛废水的新方法一隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4 溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是

A. 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
B. 阳极反应为CH3CHO-2e-+2H+=CH3COOH+H2O
C. 电解过程中,阴极区Na2SO4的物质的量增大
D. 若以CH4—空气燃料电池为直流电源,燃料电池的b 极应通入空气
【答案】A
【解析】A. 电解过程中,阳极反应为4OH--4e-═O2↑+2H2O、CH3CHO-2e-+H2O=CH3COOH+2H+,阴极反应为4H++4e-=2H2↑、CH3CHO+2e-+2H2O═CH3CH2OH+2OH-,两极除分别生成乙酸和乙醇外,均产生了无色气体,阳极产生的是O2,阴极产生的是H2,故A正确;B. 阳极反应为CH3CHO -2e-+ H2O = CH3COOH +2H+,故B错误;C. 电解过程中,阴极区SO42-的物质的量不变,所以Na2SO4的物质的量不变,故C错误;D. 若以CH4一空气燃料电池为直流电源,燃料电池的b极是负极,应通入甲烷,故D错误。故选A。

【题目】镓与ⅤA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态Ga原子的核外电子排布式为__________,基态As原子核外有__________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__________和+3。砷的电负性比镓__________(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:__________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是_______________________________________。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为__________,草酸根中碳原子的杂化方式为__________。

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,该晶体的类型为__________,晶体的密度为__________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。