题目内容
【题目】已知:①2H2(g)+O2(g)= 2H2O(g) ΔH=-483.6 kJ·mol-1
②H2(g) + S(g) = H2S(g) ΔH=-20.1 kJ·mol-1 。下列判断一定正确的是
A. 1 mol氢气完全燃烧生成H2O(g)吸收241.8 kJ热量
B. 水蒸气和硫化氢的能量相差221.7 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. 反应②中改用固态硫,1 mol H2完全反应放热将小于20.1 kJ
【答案】D
【解析】A项,1 mol氢气完全燃烧生成气态水放出热量241.8 kJ,A错误;B项,无法比较H2O(g)和1 mol H2S(g)的能量大小,B错误;C项,H2(g)+S(g)=H2S(g)ΔH =-20.1kJmol-1,H2(g)+![]() O2(g)=H2O(g)ΔH =-241.8kJmol-1,放出的热量越多,说明物质的总能量越低,物质越稳定,水比硫化氢稳定,C错误;D项,固态硫的能量低于气态硫,故D正确。
O2(g)=H2O(g)ΔH =-241.8kJmol-1,放出的热量越多,说明物质的总能量越低,物质越稳定,水比硫化氢稳定,C错误;D项,固态硫的能量低于气态硫,故D正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某实验室模拟工业硫化碱法制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取硫代硫酸钠的反应装置及所需试剂如图:
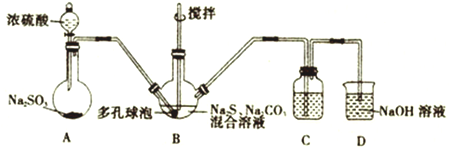
①装置A中发生反应的化学方程式为__________________________。打开分液漏斗的活塞时,发现液体不能顺利滴下,可能的原因是__________________________________。
②装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为______________________________。
③装置C是为了检验装置B中SO2的吸收效率,则C中的试剂为________________,当B中SO2的吸收效率低时,C中的现象为________________________,除搅拌和使用多孔球泡外,再写出一种提高B中SO2的吸收效率的方法:______________________________。
(2)预测并探究硫代硫酸钠的性质(反应均在溶液中进行):
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | _________ | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3 | ______ |
①探究1中的实验操作为________________________。
②探究2中的实验现象为_____________________,反应的离子方程式为_____________。