题目内容
12.空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如图1: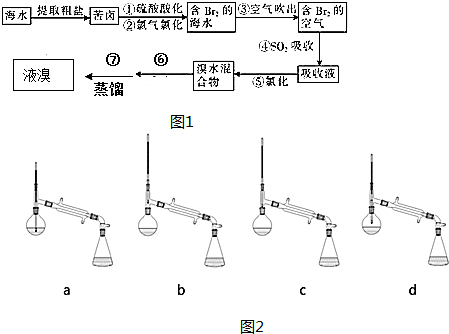
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等.
①精制除杂的步骤顺序a→c→d→e→b(填字母编号).
a.溶解,滤去沉渣; b.加入盐酸调pH; c.加入Ba(OH) 2溶液;
d.加入Na2CO3溶液; e.过滤
②此过程中一定用到的玻璃仪器有漏斗、玻璃棒、烧杯
(2)步骤④的离子方程式为Br2+SO2+2H2O═4H++SO42-+2Br-.
(3)步骤⑥的操作名称萃取、分液;分离仪器的名称是分液漏斗
(4)步骤⑦蒸馏操作中,如图2,仪器选择及安装都正确的是:b (填标号).
分析 空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴.然后,再用氯气将其氧化得到产品溴,
(1)①SO42-、Ca2+、Mg2+离子分别转化为硫酸钡、碳酸钙、氢氧化镁沉淀而除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的盐酸溶液.
②此过程中一定用到过滤操作,需要的玻璃仪器依据过滤装置选择;
(2)步骤④是利用二氧化硫的还原性还原生成的溴单质生成溴化氢和硫酸;
(3)操作⑥是从水溶液中提取溴单质,利用溴单质在水溶液中和有机溶剂中的溶解性不同,用萃取分液的方法分离,在分液漏斗中进行分液;
(4)根据温度计在该装置中的位置与作用判断.
解答 解:(1)①SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液,所以精制除杂的步骤顺序溶解,滤去沉渣,加入Ba(OH) 2溶液,加入Na2CO3溶液,过滤,加入盐酸调pH除去过量碳酸钠和氢氧根离子,
故答案为:c;d;e;
②此过程中一定用到过滤操作,一定用到的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(2)步骤④是利用二氧化硫的还原性还原生成的溴单质生成溴化氢和硫酸,反应的离子方程式为Br2+SO2+2H2O═4H++SO42-+2Br-,
故答案为:Br2+SO2+2H2O═4H++SO42-+2Br-;
(3)操作⑥是从水溶液中提取溴单质,利用溴单质在水溶液中和有机溶剂中的溶解性不同,用萃取分液的方法分离,在分液漏斗中进行分液,
故答案为:萃取、分液;分液漏斗;
(4)温度计的位置应处于蒸馏烧瓶支管口处,故adc错误,故选b,故答案为:b.
点评 本题是一道有关卤素性质的实验题,考查了学生分析和解决问题的能力,主要是流程分析,物质性质的理解应用,掌握基础是关键,难度中等.

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别配成溶液,再进行焰色反应 |
SO42-( )
①取少量溶液于试管中,滴加 BaCl2溶液,有白色沉淀产生,往沉淀中加盐酸,无明显现象
②用干净的铂丝蘸取少量原溶液进行焰色反应,发现火焰颜色为黄色.
| A. | 有现象②可知有 Na+,没有 K+ | |
| B. | 不能确定溶液中有无 Al3+ | |
| C. | 溶液中一定存在 SO${\;}_{4}^{2-}$、Na+、K+ | |
| D. | 溶液中如果存在Cl-则肯定存在 Mg2+ |
| A. | 标准状况下,11.2 L H2O中含有的分子数为0.5 NA | |
| B. | 把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol•L-1 | |
| C. | 常温常压下,16g O3中含有NA个氧原子 | |
| D. | 1 mol钠原子中含有的电子数为NA |
| A. | MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ | |
| B. | FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ | |
| C. | 酸性高锰酸钾溶液中滴加双氧水:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | 偏铝酸钠溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
| A. | 胶体是一种分散质直径小于10-10 m的分散系 | |
| B. | 胶体一定是粘稠的液体 | |
| C. | CuSO4溶液是一种胶体 | |
| D. | 可用丁达尔效应区别溶液和胶体 |
| A. | CO中混有CO2(NaOH溶液) | B. | NaOH中混有Na2CO3(盐酸) | ||
| C. | Cl2中混有HCl(饱和食盐水) | D. | KNO3溶液中混有KCl(AgNO3溶液) |
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| D. | 1升物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 数目为NA |
| A. | -14.2 KJ/mol | B. | -28.4 KJ/mol | C. | -42.6 KJ/mol | D. | -56.8 KJ/mol |