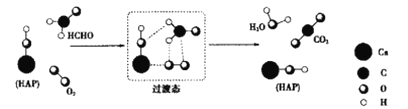
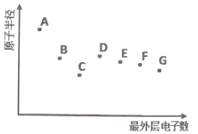
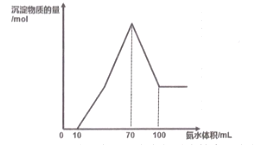
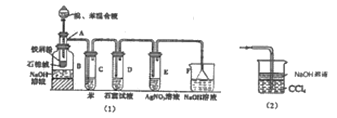
题目内容
【题目】室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
B.pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-)
C.当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
D.0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
【答案】D
【解析】
因为Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,所以H2C2O4是二元弱酸,NaOH是一元强碱,所以等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液,消耗25mL H2C2O4时溶质为NaHC2O4,消耗50mL H2C2O4时溶质为Na2C2O4,据此分析回答。
A.滴入NaOH溶液体积为25.00mL时,NaOH和草酸按1:1反应,溶质为NaHC2O4,HC2O4-既会水解,又会电离,水解为:HC2O4-+H2O![]() H2C2O4+OH-,根据Kh×Ka=Kw得:HC2O4-的水解常数Kh=
H2C2O4+OH-,根据Kh×Ka=Kw得:HC2O4-的水解常数Kh=![]() =1.85×10-13,电离为:HC2O4-
=1.85×10-13,电离为:HC2O4-![]() C2O42-+H+,其电离常数Ka= Ka2(H2C2O4)=5.4×10-5,所以电离常数Ka>水解常数Kh,故此时溶液显酸性且c(C2O42-)> c(H2C2O4),A错误;
C2O42-+H+,其电离常数Ka= Ka2(H2C2O4)=5.4×10-5,所以电离常数Ka>水解常数Kh,故此时溶液显酸性且c(C2O42-)> c(H2C2O4),A错误;
B.根据电荷守恒有:c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),pH=7时,有:c(H+)= c(OH-),所以c(Na+)=2c(C2O42-)+c(HC2O4-),B错误;
C.c(Na+)=2c(总)=2[c(H2C2O4)+c(HC2O4-)+c(C2O42-)],是Na2C2O4溶液的物料守恒,即此时溶质为Na2C2O4,Na2C2O4溶液的质子守恒为:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),C错误;
D.0.1000mol·L-1H2C2O4溶液电荷守恒式子为:c(H+)=2 c(C2O42-)+ c(HC2O4-)+c(OH-),物料守恒式子为:0.1000mol·L-1= c(H2C2O4)+ c(C2O42-)+ c(HC2O4-),用电荷守恒式子-物料守恒式子得:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4),D正确。
答案选D。