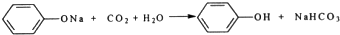题目内容
15.将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,2SO2(气)+O2(气)?2SO3(气),2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol.(1)从反应开始到达化学平衡,生成SO3的平均反应速率为0.1mol•(L•min)-1.
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)ABE.
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2.
分析 (1)根据已知条件求出氧气的反应速率结合速率之比等于对应物质的化学计量数之比计算生成SO3的平均反应速率;
(2)化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变,据此进行判断.
解答 解:(1)反应2min后,测得O2的浓度为0.8mol/L,则v(O2)=$\frac{\frac{1mol-0.8mol}{2L}}{2min}$=0.05mol/(L•min),所以v(SO3)=2v(O2)=2×0.05mol/(L•min)=0.1mol/(L•min);
故答案为:0.1 mol•L-1•min-1;
(2)A.容器内压强不再发生变化,说明反应前后气体物质的量不变,正反应速率等于逆反应速率,反应达到平衡状态,故A正确;
B.SO2的体积分数不再发生变化,说明各物质的物质的量不变,正反应速率等于逆反应速率,反应已经达到平衡状态,故B正确;
C.容器内气体原子总数始终不变,无法判断是否达到平衡状态,故C错误;
D.相同时间内消耗2n mol SO2的同时消耗n mol O2,表示的都是正反应速率,无法判断正逆反应速率是否相等,故D错误;
E.相同时间内消耗2n mol SO2等效于消耗n mol O2,同时生成n mol O2,正反应速率等于逆反应速率,反应达到平衡状态,故E正确;
故答案为:ABE.
点评 本题考查了化学反应速率的计算、化学平衡状态的判断,题目难度中等,注意掌握化学反应速率影响因素及计算方法,明确化学平衡状态的特征及判断方法.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
5.钠与水反应时的现象可以概括为“熔成小球、浮在水面、四处游走、嘶嘶作响、加入酚酞变红”,下列钠的性质中与反应现象无关的是( )
| A. | 钠的熔点低 | B. | 钠的硬度小 | ||
| C. | 钠的密度小 | D. | 钠的化学性质活泼 |
6.下列元素中,属于第ⅣA族的是( )
| A. | 钠 | B. | 镁 | C. | 碳 | D. | 氮 |
10.下列有机物中,属于烷烃的是( )
| A. | C2H6 | B. | C2H2 | C. | C6H6 | D. | C2H4O |
20.已知下列热化学方程式:
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8kJ/mol
则氢气的燃烧热为( )
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8kJ/mol
则氢气的燃烧热为( )
| A. | 438.6 kJ/mol | B. | 241.8 kJ/mol | C. | 285.8kJ/mol | D. | -285.8 kJ/mol |
7.NA代表阿伏加德罗常数,则关于热化学方程C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1300kJ•mol-1的说法中,正确的是( )
| A. | 有10NA个电子转移时,放出1300kJ的能量 | |
| B. | 有44.8LCO2气体生成时,放出1300kJ的能量 | |
| C. | 有NA个水分子生成且为液体时,吸收1300kJ的能量 | |
| D. | 有4NA个碳氧共用电子对生成时,放出1300kJ的能量 |
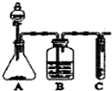 Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质