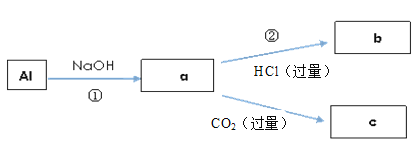
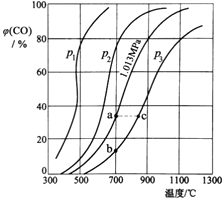
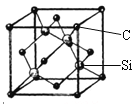
题目内容
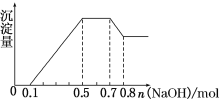
【题目】t℃时,将0.5mol/L的氨水逐滴加入10.00mL0.5mol/L盐酸中,溶液中温度变化曲线Ⅰ、pH变化曲线Ⅱ与加入氨水的体积的关系如图所示(忽略混合时溶液体积的变化)。下列说法正确的是( )

A.Kw的比较:a点比b点大
B.b点氨水与盐酸恰好完全反应,且溶液中c(NH4+)=c(Cl-)
C.c点时溶液中c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D.d点时溶液中c(NH3H2O)+2c(OH-)=c(NH4+)+2c(H+)
【答案】D
【解析】
A.在溶液中存在水的电离平衡,水的电离过程吸收热量,升高温度,水的电离程度增大,Kw增大,根据图示可知,溶液温度b>a,所以Kw:b>a,A错误;
B.HCl与氨水混合,当氨水的体积为10mL时,二者恰好反应产生NH4Cl,该盐是强酸弱碱盐,在溶液中NH4+发生水解反应而消耗,所以溶液中c(NH4+)<c(Cl-),B错误;
C.在c点溶液中存在NH4Cl、H2O,存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于盐电离产生的离子浓度远大于水电离产生的离子浓度,所以溶液中四种离子的浓度不可能相等,C错误;
D.d点时溶液为NH4Cl与氨水等物质的量浓度混合溶液,存在电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),同时存在物料守恒:c(NH4+)+c(NH3H2O)=2c(Cl-),将第一个式子扩大2倍,与第二个式子相减,整理可得:c(NH3H2O)+2c(OH-)=c(NH4+)+2c(H+),D正确;
故合理选项是D。

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:
分析表中数据回答下列问题:
MnO2 时间 H2O2 | 0.1g | 0.3g | 0.8g |
10mL1.5% | 223s | 67s | 56s |
10mL3.0% | 308s | 109s | 98s |
10mL4.5% | 395s | 149s | 116s |
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是__________________________________。
(4)为加快过氧化氢的分解速率,除了使用MnO2作催化剂和改变过氧化氢的质量分数之外,还可以采取的加快反应速率的措施有_____。(回答任意两个合理的措施)