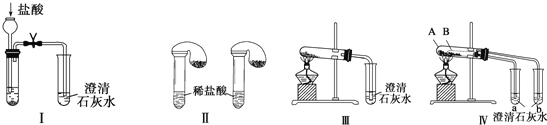
题目内容
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
(1)基态铜原子的电子排布式为_______________;已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是_________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为____________,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si(填“>”、“<”)。
(3)SeO2常温下白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体的晶体类型为_________;若SeO2类似于SO2是V型分子,则Se原子外层轨道的杂化类型为_________。
(4)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______,B与N之间形成_________键。
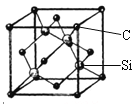
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为________,在SiC中,每个C原子周围最近的C原子数目为___个;若晶胞的边长为a pm,则金刚砂的密度表达式为_________g/cm3。
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 CuO中铜的价层电子排布为3d94s0,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是 V形、正四面体形 > 分子晶体 sp2 sp3 配位 原子晶体 12 ![]() 或
或![]()
【解析】
(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1;CuO中铜的价层电子排布为3d94s0(1分),Cu2O中铜的价层电子排布为3d10,3d10为稳定结构,所以在高温时,能生成Cu2O;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别V形,正四面体;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si;
(3)SeO2常温下白色晶体,熔、沸点低,为分子晶体;二氧化硒分子中价层电子对=2+![]() (6-2×2)=3,Se原子的杂化类型为sp2,且含有一个孤电子对,所以属于V形;
(6-2×2)=3,Se原子的杂化类型为sp2,且含有一个孤电子对,所以属于V形;
(4)BF3NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键;
(5)金刚砂(SiC)的硬度为9.5,属于原子晶体;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个碳原子周围最近的碳原子数目为3×4=12;该晶胞中C原子个数=8×![]() +6×
+6×![]() =4,Si原子个数为4,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,ρ=
=4,Si原子个数为4,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,ρ=![]() =
=![]() 或
或![]() gcm3。
gcm3。