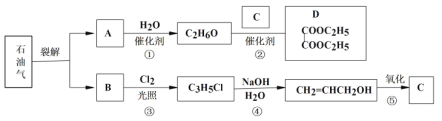
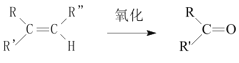
题目内容
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)钠元素的金属性比铝的________(填“强”或“弱”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为______________________;
(3)填写a、b、c化学式并书写①的离子方程式(a、b、c均为含Al化合物);
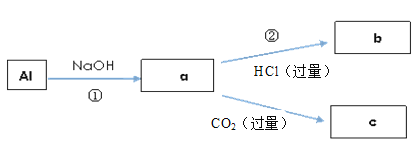
a:__________,b:___________,c:__________;①________;
(4)取一定量的FeCl3,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。
b.向另一支试管中滴加NaOH溶液,反应的离子方程式是______________。
【答案】强 2Na+2H2O=2Na++2OH-+H2↑ NaAlO2 AlCl3 Al(OH)3 2Al+2H2O+2OH-=2![]() +3H2↑ 红 Fe3++3OH-=Fe(OH)3↓
+3H2↑ 红 Fe3++3OH-=Fe(OH)3↓
【解析】
(1)同周期元素的金属性从左到右依次减弱,因此Na元素的金属性比铝的强;
(2)钠和水反应生成NaOH和H2,离子方程式为2Na+2H2O=2Na++2OH-+H2↑;
(3)根据流程图,Al和NaOH反应生成NaAlO2和氢气,向NaAlO2溶液中加入过量的HCl,开始生成的Al(OH)3会溶于过量的HCl,最终生成AlCl3、NaCl和水;如果向NaAlO2溶液中通入过量的CO2,最终得到Al(OH)3和NaHCO3;则a为NaAlO2,b为AlCl3,c为Al(OH)3;反应①为2Al+2H2O+2OH-=2![]() +3H2↑;
+3H2↑;
(4)a.FeCl3溶液中滴加KSCN溶液,溶液变红色;
b.FeCl3溶液和NaOH溶液反应生成Fe(OH)3红褐色沉淀,离子方程式为Fe3++3OH-=Fe(OH)3↓。