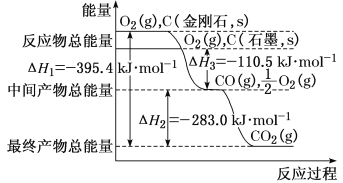
题目内容
【题目】某溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的几种。
中的几种。
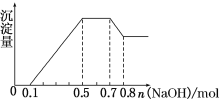
①若加入锌粒,用排空气法收集到无色无味气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是( )
A.溶液中的阳离子有H+、Mg2+、Al3+、![]()
B.溶液中n(Mg2+)=0.1 mol
C.溶液中一定不含![]() 、
、![]() 、Fe3+
、Fe3+
D.n(![]() ∶n(Al3+)∶n(Mg2+)=4∶2∶1
∶n(Al3+)∶n(Mg2+)=4∶2∶1
【答案】B
【解析】
根据①可知,溶液显酸性,则溶液中一定不存在CO32-和NO3-,根据②可知,产生的是白色沉淀,说明不存在Fe3+,根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+,又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,根据溶液电中性可知,溶液中一定存在阴离子SO42-。
根据图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol,第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol,最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol-0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol,第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol-0.1mol=0.4mol,则n(Mg2+)=(0.4mol-0.1mol×3)×0.5=0.05mol。
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,故A选项正确。
B.根据以上分析可知,n(Mg2+)=0.05mol,故B选项错误。
C.由上述分析可知,溶液中一定不含CO32-、NO3-、Fe3+,故C选项正确。
D.由上述分析可知,溶液中n(NH4+):n(Al3+):n(Mg2+)=0.2mol:0.1mol:0.05mol=4:2:1,故D选项正确。
故答案选B。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案