题目内容
短周期主族元素A、B、C、D、E、F的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,C原子最外层电子数是E原子最外层电子数的3倍,B、F原子最外层电子数之和等于C、E原子最外层电子数之和。
请回答下列问题:
(1)B元素在元素周期表中的位置为____________ 。
(2)元素C和D可形成两种化合物D2C、D2C2,其中均含有的化学键类型是______________;元素E、F形成的最高价氧化物对应水化物的碱性强弱关系为_____>_____ (填化学式)。
(3)E的单质能与A的最高价氧化物发生置换反应,反应的化学方程式为_____________;
(4)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为______________.
(1)第2周期VA族 (2)离子键 Mg(OH)2、Al(OH)3
(3)2Mg+CO2 2MgO+C (4)2Al+2OH-+6H2O ="==" 2[Al(OH)4]-+3H2↑
2MgO+C (4)2Al+2OH-+6H2O ="==" 2[Al(OH)4]-+3H2↑
解析试题分析:根据题意可推知个元素分别是:A:C;B:N;C:O;D:Na;E:Mg;F:Al.
(1)N元素在元素周期表中的位置是第二周期第VA族。
(2)O、Na两元素形成的化合物为Na2O、Na2O2,二者都是离子化合物,都含有离子键。元素的金属性Mg>Al.元素的金属性越强,其最高价氧化物对应水化物的碱性就越强。故Mg(OH)2和Al(OH)3的碱性强弱关系为Mg(OH)2>Al(OH)3。
(3)Mg和CO2发生反应的化学方程式为:2Mg+CO2 2MgO+C
2MgO+C
(4)Al和NaOH溶液反应的离子方程式为:2Al+2OH-+6H2O ="==" 2[Al(OH)4]-+3H2↑(或2Al+2OH-+2H2O =2AlO2-+3H2↑)
考点:考查元素的推断及元素与化合物的性质的知识。

 阅读快车系列答案
阅读快车系列答案a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c与f反应可形成两个g分子。试写出:
(1)a粒子的核外电子排布式______________________________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱为:________>________ (用化学式表示)。
(3)d溶于水的电离方程式__________________________________________。
(4)c粒子是__________,f粒子是__________(用化学式表示)。
(5)g粒子的共价键数是_____而不是更多,说明共价键具有 性。
X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的
 键数目为 。
键数目为 。(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目 。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ?mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ?mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | 最外层电子数是内层电子数的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(2)化合物A的溶液呈碱性,用离子方程式解释其原因: ,该化合物起消毒作用的微粒是 。
(3)将Y与Z形成的化合物的水溶液逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴边振荡),写出此过程中发生反应的离子方程式
、 。

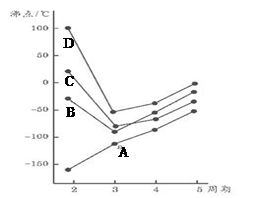
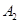 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。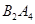 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。