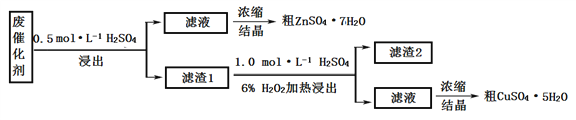
��Ŀ����
����Ŀ����ͼ��ÿ�����ʾ�йص�һ�ַ�Ӧ�������������е���ĸ���й���Ҫ��Ӧ���������Ĵ��룬����C��E��G��I��X���³�ѹ�������塣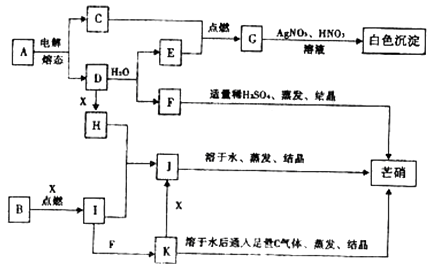
��1��B�Ļ�ѧʽΪ��H�ĵ���ʽΪ��
��2��д��A�ĵ�ⷽ��ʽ��
��3��д������H������I��Ӧ����J�Ļ�ѧ����ʽ����ע������ת�Ƶķ������Ŀ��
��4����C����ͨ��K��Һ����Һ��pH����(�����ߡ����͡���)��д���÷�Ӧ�����ӷ���ʽ��
��5��д��D��ˮ��Ӧ�����ӷ���ʽ��
���𰸡�
��1��S��![]()
��2��2NaCl(����) ![]() 2Na��Cl2��
2Na��Cl2��
��3��
��4�����ͣ�SO32��+Cl2+2H2O=SO42��+2Cl��+4H+
��5��2Na+2H2O=2Na++H2��+2OH-��2�֣�
��������C��E��G��I���³�ѹ�������壬�������и�����ת����ϵ��C��E��ȼ����G��G�������ữ����������Ӧ���ɰ�ɫ�����������֪GΪHCl��C��EΪH2��Cl2 �� E��D��ˮ��Ӧ�õ�������EΪH2 �� ��CΪCl2 �� â������Ҫ�ɷ�Ϊ�����ƣ����Կ���֪DΪNa��FΪNaOH����AΪNaCl��J����ˮ�����ᾧ��â��������JΪNa2SO4 �� K��ͨ�������������ᾧҲ�ܵõ������ƣ�������������ǿ�������ԣ���KΪ���л�ԭ�Ե�Na2SO3 �� K��������Ӧ����J������XΪO2 �� ����B��X��ȼ������I��I��H����J����I��������K����֪��BΪS��IΪSO2 �� HΪNa2O2��
(1)�����Ϸ�����֪BΪS��HΪNa2O2 �� �����ʽΪ ![]() ��
��
(2)AΪNaCl��������ڵ�NaCl�����ƺ�����������ʽΪ2NaCl(����) ![]() 2Na��Cl2����
2Na��Cl2����
(3)Na2O2������SO2��Ӧ����Na2SO4 �� ��Ӧ����ʽ�ǣ�Na2O2+SO2=Na2SO4 �� �ڸ÷�Ӧ��Na2O2�������������е�-1�۵�O��õ��ӡ���ΪNa2SO4��-2�۵�O����SO2�е�+4�۵�S��������Ϊ�������е�+6�۵�S����˫���ŷ���ʾ����ת��Ϊ��  ��
��
��4����Cl2ͨ��Na2SO3��Һ����������ԭ��Ӧ���������ƺ����ᣬ���ݵ����غ㡢����غ㼰ԭ���غ�ɵ÷�Ӧ�����ӷ���ʽΪSO32��+Cl2+2H2O=SO42��+2Cl��+4H+��(5)D��Na���ƺ�ˮ��Ӧ�����������ƺ���������Ӧ�����ӷ���ʽΪ2Na+2H2O=2Na++H2��+2OH-��
���ݳ��³�ѹ��������ļ������ʵ�ת����ϵ��Ϊͻ�ƿڽ����ƶϸ������ʣ�Ȼ���ϵ���ʽ����д���Ȼ��Ƶĵ���Լ�������ԭ��Ӧ���н�ɡ�

 ��������ϵ�д�
��������ϵ�д� ����˼ά����ѵ����ʱ��ѧ��ϵ�д�
����˼ά����ѵ����ʱ��ѧ��ϵ�д�����Ŀ����֪���ݣ�
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 |
�Ҵ� | ��117.3 | 78.5 | 0.789 |
���� | 16.6 | 117.9 | 1.05 |
�������� | ��83.6 | 77.5 | 0.90 |
Ũ����(98%) | �� | 338.0 | 1.84 |
ʵ������ȡ������������Ҫ�������£�����30 mL�Ĵ��Թ�A�а������1��4��4�ı�������Ũ���ᡢ�Ҵ�������Ļ����Һ������ͼ1���Ӻ�װ��(װ������������)����С����ȵؼ���װ�л��Һ�Ĵ��Թ�3��5 min�������Թ�B�ռ���һ���������ֹͣ���ȣ���ȥ�Թ�B��������Ȼ���÷ֲ㣻

ͼ1
����������������㡢ϴ�Ӻ��
�������ĿҪ��ش��������⣺
��1��д����ȡ���������Ļ�ѧ����ʽ��________________________________________________________________________��
��2������ʵ���б���̼������Һ��������______(����ĸ����)��
A����Ӧ��������Ҵ�
B����Ӧ�����Ტ���ղ����Ҵ�
C�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�еĸ�С�������ڷֲ�����
D�������������ɣ���������
��3������������Ҫ��С����ȼ��ȣ�����Ҫԭ����________________________________________________________________________��
��4��ij��ѧ����С�������ͼ2��ʾ����ȡ����������װ��(����̨�����С�����װ�þ�����ȥ)��
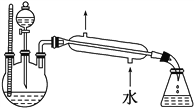
ͼ2
��ͼ1��ʾװ����ȣ���װ�õ���Ҫ�ŵ���________________________________________________________________��