题目内容
6.(1)某溶液中Cl-、Br-、I-的物质的量之比为2:3:4,要使溶液中的Cl-、Br-、I-的物质之比变为4:3:2,则通入Cl2的物质的量与原溶液中I-的物质的量之比为1:4.(2)要使溶液中含有Cl-和Br-,I-恰好变为0,则此时Cl-和Br-的物质的量之比为2≤$\frac{n(C{l}^{-})}{n(B{r}^{-})}$<3.
(3)若要使溶液中只有Cl-,则通入Cl2的物质的量和原溶液中Br-的物质的量之比为7:6.
(4)下列化合物中所有原子或离子都满足最外层为8电子结构的是ABDE.
A.MgCl2B.IClC.NO2D.NCl3E.CS2.
分析 (1)离子的还原性:I->Br->Cl-,由于反应中I-有剩余,则Br-没有被氧化,通入氯气只发生Cl2+2I-=2Cl-+I2,由反应可知,溶液中离子总物质的量不变,故溶液中Br-离子物质的量不变,结合离子的物质的量的变化计算;
(2)离子的还原性:I->Br->Cl-,由于反应中I-有剩余,则Br-没有被氧化,通入氯气只发生Cl2+2I-=2Cl-+I2,设原溶液中Cl-、Br-、I-离子的物质的量分别为2xmol、3xmol、4xmol,要使溶液中只有Cl-和Br-,而没有I-,可能是碘离子恰好完全反应或者是溴离子部分反应;
(3)设原溶液中Cl-、Br-、I-离子的物质的量分别为2xmol、3xmol、4xmol,若要使溶液中只有Cl-,根据得失电子守恒,则通入Cl2的物质的量为$\frac{7x}{2}$mol;
(4)根据原子最外层电子数和化合价判断,在共价化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,离子化合物中根据最外层电子的变化分析.
解答 解:(1)离子的还原性:I->Br->Cl-,由于反应中I-有剩余,则Br-没有被氧化,通入氯气只发生Cl2+2I-=2Cl-+I2,设溶液中Cl-、Br-、I-离子的物质的量分别为2xmol、3xmol、4xmol,由反应后离子物质的量关系可知反应离子的物质的量分别为4xmol、3xmol、2xmol,则Cl-的物质的量增加2xmol,I-的物质的量减少2xmol,则通入氯气xmol,则通入Cl2物质的量与原溶液中I-物质的量之比为x:4x=1:4,即为1:4,
故答案为:1:4;
(2)离子的还原性:I->Br->Cl-,由于反应中I-有剩余,则Br-没有被氧化,通入氯气只发生Cl2+2I-=2Cl-+I2,设原溶液中Cl-、Br-、I-离子的物质的量分别为2xmol、3xmol、4xmol,要使溶液中只有Cl-和Br-,而没有I-,可能是碘离子恰好完全反应时需氯气的量为:2xmol氯气,生成4xmolCl-,此时溶液中氯离子的物质的量为6xmol;溴离子恰好完全反应需要氯气$\frac{7x}{2}$mol,此时溶液中的氯离子为9xmol;所以则此时Cl-和Br-的物质的量之比为2≤$\frac{n(C{l}^{-})}{n(B{r}^{-})}$<3,
故答案为:2≤$\frac{n(C{l}^{-})}{n(B{r}^{-})}$<3;
(3)设原溶液中Cl-、Br-、I-离子的物质的量分别为2xmol、3xmol、4xmol,若要使溶液中只有Cl-,根据得失电子守恒,则通入Cl2的物质的量为$\frac{7x}{2}$mol,通入Cl2的物质的量和原溶液中Br-的物质的量之比为7:6,
故答案为:7:6;
(4)A.MgCl2中,镁离子的最外层电子为:8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故A正确;
B.ICl中,I原子的最外层电子为:7+1=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故B正确;
C.NO2中,N原子的最外层电子为:5+4=9,O原子的最外层电子为:6+|-2|=8,不都满足8电子稳定结构,故C错误;
D.NCl3中,N原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故D正确;
E.CS2中,C原子的最外层电子为:4+4=8,S原子的最外层电子为:6+|-2|=8,都满足8电子稳定结构,故E正确.
故答案为:ABDE.
点评 本题考查氧化还原反应的计算、8电子稳定结构的判断,题目难度不大,本题注意把握离子的还原性强弱,判断发生的反应是关键,在根据反应的离子方程式计算.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 1p | B. | 2d | C. | 3f | D. | 4s |
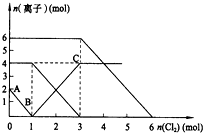 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 | |
| D. | 原混合溶液中FeBr2的物质的量为2mol |
| A. | HCl NaCl | B. | SiO2 CO2 | C. | CaCl2 ?CCl4 | D. | PH3 SO2 |
| 元素 | 相关信息 |
| X | 它存在多种同素异形体,可用于制作钻头、电极和纳米材料 |
| Y | 最外层电子数是内层电子数的3倍 |
| Z | 第三周期中最高价氧化物的水化物碱性最强 |
| W | 与X元素处于同一主族,工业上常用X的单质还原W的氧化物制取W单质 |
| A. | 原子子半径:W>Z>Y>X | |
| B. | Y、Z两种元素只能形成化合物Z2Y | |
| C. | 最低价气态氢化物的热稳定性:W>X | |
| D. | 最高价氧化物对应水化物的酸性:X>W |
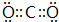 .
.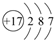 .
. .
.
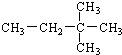 2,2-二甲基-丁烷
2,2-二甲基-丁烷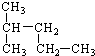 2-甲基-戊烷.
2-甲基-戊烷.