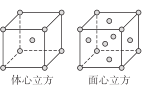
题目内容
【题目】I.某有机物的结构简式如图所示,关于该有机物的说法不正确的是

A.该有机物的化学式为C20H14O5
B.该有机物分子中的三个苯环不可能共平面
C.该有机物可发生加成、取代、氧化、消去等反应
D.1 mol该有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为500mol
II.绿原酸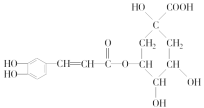 是一种抗氧化药物,存在如图所示的转化关系。
是一种抗氧化药物,存在如图所示的转化关系。

(1)绿原酸中的含氧官能团有酯基、________。
(2)B的分子式是__________________。
(3)C的氧化产物能发生银镜反应,则C→D的化学方程式是_______________。
(4)咖啡酸苯乙酯的结构简式是_______。
(5)1 mol A与足量的H2、浓溴水作用,最多可消耗H2________mol,浓溴水________mol。
(6)F是A的同分异构体,F分别与碳酸氢钠溶液或新制Cu(OH)2溶液反应产生气体或红色沉淀;苯环上只有两个取代基,且核磁共振氢谱表明该有机物中有8种不同化学环境的氢。
①符合上述条件的F有________种可能的结构;
②若F还能与NaOH在常温下以物质的量之比1∶2完全反应,其化学方程式为________ (任写1个)。
【答案】Ⅰ、C Ⅱ、(1)羟基、羧基 、酯基 (
2)C7H12O6
(3)![]()
(4)![]()
(5)4;4
(6)① 6 ② ![]() (或
(或 ![]() )
)
【解析】
试题分析:Ⅰ、A.根据有机物结构简式可知该有机物的化学式为C20H14O5,A正确;B.连接3个苯环的C原子是sp3杂化,即呈三角锥结构,故三个苯环不可能在同一平面,B正确;C.从结构上看,该有机物存在酚羟基和苯环可以发生加成、取代、氧化反应,但是物质结构中没有相邻两个碳原子通式含有H的结构,故无法发生消去反应,C错误;D.该有机物的结构中含有2个酚羟基,水解后生成1个酚羟基,2个羧基,故1mol该有机物与足量NaOH 溶液充分反应,消耗NaOH5 mol,D正确,答案选C。
Ⅱ、根据绿原酸的结构可知A、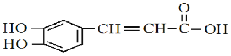 ;B、
;B、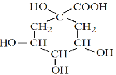 ;由C到聚苯乙烯的转化且C的氧化产物能发生银镜反应,可知C、
;由C到聚苯乙烯的转化且C的氧化产物能发生银镜反应,可知C、![]() ;D、
;D、![]() 。
。
(1)绿原酸中的含氧官能团有酯基、羟基、羧基;
(2)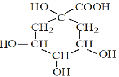 的分子式:C7H12O6;
的分子式:C7H12O6;
(3)C→D的化学方程式是:![]() 。
。
(4)A与C发生酯化反应生成咖啡酸苯乙酯的结构简式是![]() ;
;
(5)苯环和碳碳双键均能与氢气分子加成反应,酚羟基的邻位和对位氢原子能把溴原子取代,碳碳双键能与溴水发生加成反应,则1 mol A与足量的H2、浓溴水作用,最多可消耗H24mol,浓溴水4mol。
(6)①根据F分别与碳酸氢钠溶液或新制Cu(OH)2反应产生气体或红色沉淀可知分子中有-COOH和-CHO两种基团;苯环上只有两个取代基,且核磁共振氢谱表明该有机物中有8种不同化学环境的氢考点两取代基可以是-COOH和-CH(OH)-CHO或者-OH和-CH(-COOH)-CHO两种组合符合,两取代基可分别有邻间对的位置关系,共6种。
②由于-COOH和-OH均消耗NaOH,反应的方程式为![]()
或 ![]() 。
。

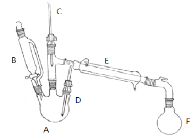
【题目】实验室制取溴乙烷的主反应如下:

副反应:在该实验中经常会有乙醚、溴等副产物生成,装置如图所示。
相对分子质量 | 密度/(g·cm—3) | 沸点/℃ | 溶解度 | |
乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
实验步骤:
①向A中先加入5 mL 95%的无水乙醇(0.085 mol)和4.5 mL的水,加入溴化钠7.725 g ,再加入沸石,摇匀。在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中。
②在B中加入9.5 mL浓硫酸(0.17 mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2 mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加入沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g。
回答问题:
(1)仪器E的名称为 ;反应装置中有使用C、D两根温度计,其中D温度计的作用是: 。
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是 。饱和亚硫酸氢钠溶液的作用是 ;
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有 (填标号)。
A.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 D.减少因浓硫酸氧化HBr而生成副产物溴;
(4)步骤③中分出馏出液中有机层的操作名称为 。加入浓硫酸除杂后的溶液明显分层,粗产物在 层(填“上”或“下”);
(5)本实验的产率为 。