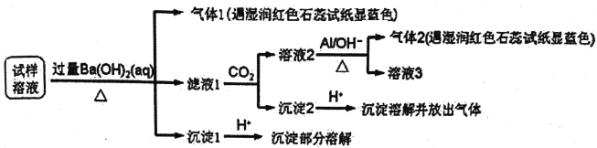
题目内容
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___________。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①(H3PO2)中,磷元素的化合价为___________。
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___________(填化学式);
③NaH2PO2是 正盐还是酸式盐?___________,其溶液显___________性(填“弱酸性”、“中性”、或者“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式___________。
(4)(H3PO2)也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是___________杂质。该杂质产生的原因是___________。
【答案】
(1)H3PO2![]() H2PO2-+H+;
H2PO2-+H+;
(2)①+1;②H3PO4;③正盐;碱性;
(3)2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑.
(4)①4OH--4e-=O2↑+2H2O;②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2;③PO43-;H2PO2-或H3PO2被氧化
【解析】
试题分析:(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为H3PO2![]() H2PO2-+H+,故答案为:H3PO2
H2PO2-+H+,故答案为:H3PO2![]() H2PO2-+H+;
H2PO2-+H+;
(2)①H3PO2中,总化合价为0,其中氢元素为+1价,氧元素为-2价,则P元素的化合价为+1价,故答案为:+1;
②该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4;故答案为:H3PO4;
③由于H3PO2是一元中强酸,所以NaH2PO2为一元强碱和一元中强酸形成的正盐,所以该盐溶液由于H2PO2-发生水解呈碱性,方程式为H2PO2-+H2OH3PO2+OH-,故答案为:正盐;碱性;
(3)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,反应方程式为2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑;
(4)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH--4e-=O2↑+2H2O;故答案为:4OH--4e-=O2↑+2H2O;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,故答案为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2-或H3PO2氧化成PO43-,产品中混有PO43-,故答案为:PO43-;H2PO2-或H3PO2被氧化。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室制取溴乙烷的主反应如下:

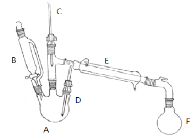
副反应:在该实验中经常会有乙醚、溴等副产物生成,装置如图所示。
相对分子质量 | 密度/(g·cm—3) | 沸点/℃ | 溶解度 | |
乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
实验步骤:
①向A中先加入5 mL 95%的无水乙醇(0.085 mol)和4.5 mL的水,加入溴化钠7.725 g ,再加入沸石,摇匀。在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中。
②在B中加入9.5 mL浓硫酸(0.17 mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2 mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加入沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g。
回答问题:
(1)仪器E的名称为 ;反应装置中有使用C、D两根温度计,其中D温度计的作用是: 。
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是 。饱和亚硫酸氢钠溶液的作用是 ;
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有 (填标号)。
A.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 D.减少因浓硫酸氧化HBr而生成副产物溴;
(4)步骤③中分出馏出液中有机层的操作名称为 。加入浓硫酸除杂后的溶液明显分层,粗产物在 层(填“上”或“下”);
(5)本实验的产率为 。