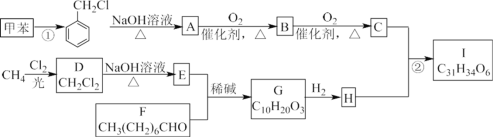
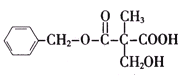
题目内容
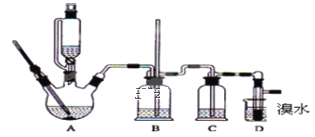
【题目】实验室用少量的溴水和足量的乙烯制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式:___________________________________。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞.请写出发生堵塞时瓶B中的现象:______________________________________________________。
(3)在装置C中应加入_____(填字母),(a.水 b.浓硫酸 c.氢氧化钠溶液)其目的是 ___________________________________________________________________。
(4)若产物中有少量副产物乙醚,可用 ________________ 的方法除去。
(5)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 _________________________________________________________________________。
【答案】CH3CH2OH![]() CH2=CH2↑+H2O; B中水面会下降,玻璃管中水柱会上升。 c 除去CO2和SO2 蒸馏 过度冷却会使使产品凝固而使气路堵塞
CH2=CH2↑+H2O; B中水面会下降,玻璃管中水柱会上升。 c 除去CO2和SO2 蒸馏 过度冷却会使使产品凝固而使气路堵塞
【解析】
装置A:乙醇在浓硫酸、加热条件下发生消去反应生成乙烯,浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,装置B:B为安全瓶,可以防止倒吸,装置D生成1,2-二溴乙烷,反应后容器内气压减小,1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,根据B中内外液面高低变化,可以判断是否发生堵塞,装置C:二氧化碳、二氧化硫能和氢氧化钠溶液反应,二氧化硫能与溴反应,盛放氢氧化钠溶液除去乙烯中的二氧化碳、二氧化硫,装置D:乙烯与溴反应生成1,2-二溴乙烷;溴易挥发,为防止污染空气,D装置之后需要连接盛放氢氧化钠溶液吸收尾气装置。
(1)、三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下加热到170℃产生乙烯;
(2)、1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据玻璃导管中内外液面高低变化,可以判断是否发生堵塞;
(3)、浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,二氧化碳在水中溶解度小,浓硫酸既不能吸收二氧化碳,也不能吸收二氧化硫,饱和碳酸氢钠溶液不能吸收二氧化碳;
(4) 1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(5)、乙烯与溴反应时放热,冷却可避免溴的大量挥发,但不能过度冷却(如用冰水),否则使气路堵塞;
(1)、A中乙醇发生消去反应生成乙烯,反应方程式为: CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
故答案为:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(2)、1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据玻璃导管中内外液面高低变化,可以判断是否发生堵塞;
故答案为B中水面会下降,玻璃管中水柱会上升;
(3)、浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,所以制取的乙烯气体中会含有CO2和SO2,而SO2具有还原性,也能使溴水褪色,故装置C中盛有的溶液需吸收乙烯中的杂质气体二氧化碳和二氧化硫的,水吸收二氧化碳能力弱,浓硫酸不吸收二氧化碳、二氧化硫,饱和碳酸氢钠溶不吸收二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应被吸收,SO2+ 2NaOH=Na2SO3+ H2O, CO2+ 2NaOH=Na2CO3+ H2O,不和乙烯反应,故选用氢氧化钠溶液。
故答案为: c;除去CO2和SO2;
(4)、若产物中有少量副产物乙醚,1, 2-二溴乙烷与混有的乙醚互溶,但沸点不同,可用蒸馏的方法除去,
故答案为:蒸馏;
(5)、溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,
故答案为:过度冷却会使使产品凝固而使气路堵塞。