题目内容
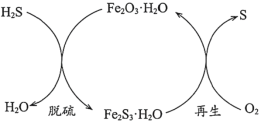
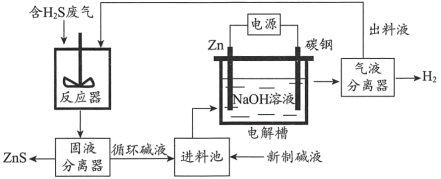
【题目】汽车尾气污染是由汽车排放的废气造成的环境污染。主要污染物为一氧化碳、碳氢化合物、氮氧化合物等,对人类和动、植物危害甚大。解决汽车尾气问题的主要方法是研究高效催化剂促使尾气中的一氧化碳和氮氧化物反应,转化成无污染的氮气和二氧化碳。
回答下列问题:
(1)在Co+的催化作用下,CO(g)还原N2O(g)的反应历程和能量变化如图所示(逸出后物质认为状态下发生变化,在图中略去)。已知总反应的化学方程式为:CO(g)+N2O(g)![]() CO2(g)+N2(g)。
CO2(g)+N2(g)。
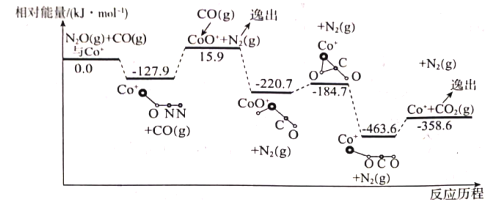
该反应分两步进行:
第一步:Co+(s)+N2O(g)![]() CoO+(s)+N2(g) △H1=+15.9kJmol-1;
CoO+(s)+N2(g) △H1=+15.9kJmol-1;
笫二步:___;△H2=___;
①填写第二步反应的热化学方程式,并根据反应历程图计算△H2的数值。
②该反应的最高能垒(活化能)为___。
(2)500℃条件下,在容积均为2L的三个密闭容器中,按不同方式投入反应物,发生上述反应,测得相关数据如下表:
容器 | 反应物投入的量 | 平衡时 n(N2/mol) | 达到平衡所需时间/min | 平衡时能量变化/kJ |
甲 | 1molCO和1molN2O | n1 | t1 | 放热Q1 |
乙 | 2molCO和2molN2O | n2 | t2 | 放热Q2 |
丙 | 2molCO2和2molN2 | n3 | t3 | 吸热Q3 |
①Q1+![]() ___358.6(填“>”“=”或“<”下同,t1___t2;
___358.6(填“>”“=”或“<”下同,t1___t2;
②500℃条件下,乙和丙两容器,气体混合物中N2O的物质的量分数x(N2O)与反应时间t的关系如下表:
t/s | 0 | 20 | 40 | 60 | 80 | 120 | |
乙 | x(N2O) | 0.5 | 0.32 | 0.20 | 0.12 | 0.088 | 0.07 |
丙 | x(N2O) | 0 | 0.030 | 0.048 | 0.059 | 0.065 | 0.07 |
根据上述实验结果,计算出乙容器中0~20s时间内的化学反应速率v(CO)=___;该反应的平衡常数K数值为:___;(保留3位有效数字)
③请推测并在图中画出甲容器中x(N2O)随时间变化的关系图象,标出恰好达到平衡时刻点的位置___。

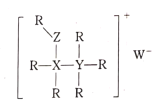
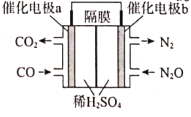
(3)若将CO(g)还原N2O(g)的反应设计成如图的原电池装置,则该电池正极的电极反应式为___。
【答案】CoO+(s)+CO(g)![]() Co+(s)+CO2(g) -374.5kJmol-1 143.8kJmol-1 = > 0.018molL-1s-1 37.7
Co+(s)+CO2(g) -374.5kJmol-1 143.8kJmol-1 = > 0.018molL-1s-1 37.7 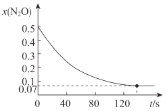 [达到平衡时,x(N2O)=0.07对应的点在120s之后即可] N2O+2e-+2H+=N2+H2O
[达到平衡时,x(N2O)=0.07对应的点在120s之后即可] N2O+2e-+2H+=N2+H2O
【解析】
(2)有反应历程可知CO(g)+N2O(g)![]() CO2(g)+N2(g)△H=-358.6kJ/mol,该反应属于气体反应前后气体系数相等的可逆反应,只要初始加入反应物的量成比例,达到平衡时两个容器中各气体的百分含量相等,属于等效平衡。
CO2(g)+N2(g)△H=-358.6kJ/mol,该反应属于气体反应前后气体系数相等的可逆反应,只要初始加入反应物的量成比例,达到平衡时两个容器中各气体的百分含量相等,属于等效平衡。
(1)①总反应方程式为CO(g)+N2O(g)![]() CO2(g)+N2(g);第一步反应为Co+(s)+ N2O(g)
CO2(g)+N2(g);第一步反应为Co+(s)+ N2O(g)![]() CoO+(s)+ N2(g)H1=+15.9kJmol-1;第二步反应=总反应-第一步反应,所以第二步反应为CoO+(s)+CO(g)
CoO+(s)+ N2(g)H1=+15.9kJmol-1;第二步反应=总反应-第一步反应,所以第二步反应为CoO+(s)+CO(g)![]() Co+(s)+CO2(g);据图可知该反应初始时的相对能量为+15.9kJ/mol,末态的相对能量为-358.6kJ/mol,所以该反应的△H2=-358.6kJ/mol-15.9kJ/mol=-374.5 kJ/mol;
Co+(s)+CO2(g);据图可知该反应初始时的相对能量为+15.9kJ/mol,末态的相对能量为-358.6kJ/mol,所以该反应的△H2=-358.6kJ/mol-15.9kJ/mol=-374.5 kJ/mol;
②根据反应历程图像中的数据可知,有-127.9 kJ/mol到+15.9 kJ/mol这两个能量状态之间转化过程中垒能最高,为143.8 kJ/mol;
(2)①丙中投料为2molCO2和2molN2,完全转化相当于2molCO和2molN2O,所以平衡时与甲容器为等效平衡,又因为丙中投料为甲的2倍,所以Q1+![]() =358.6kJ/mol;甲乙两个容器中反应物的物质的量浓度不同,乙容器中浓度更大,反应速率更快,所以t1> t2;
=358.6kJ/mol;甲乙两个容器中反应物的物质的量浓度不同,乙容器中浓度更大,反应速率更快,所以t1> t2;
②该反应前后气体系数之和相等,所以反应过程中气体的总物质的量不变,为2mol+2mol=4mol,乙容器中0~20s时间内的化学反应速率v(N2O)=![]() 0.018molL-1s-1,同一反应同一时段内反应速率之比等于计量数之比,所以v(CO)= v(N2O)= 0.018molL-1s-1;
0.018molL-1s-1,同一反应同一时段内反应速率之比等于计量数之比,所以v(CO)= v(N2O)= 0.018molL-1s-1;
丙中投料极限转化和乙完全相同,所以两容器达到平衡时各物质的物质的量分数相同,根据表格数据可知120s后,两容器中N2O的物质的量分数均为0.07,所以此时反应达到平衡,平衡时,N2O的物质的量分数为0.07,根据反应方程式可知,CO为0.07,N2为0.43,CO2为0.43,该反应前后气体系数之和相等,所以可以用物质的量分数代替浓度计算平衡常数,所以K=![]() ;
;
③由于是等效平衡,甲容器比乙容器的压强小,反应速率慢,所以甲容器中N2O的物质的量分数x(N2O)与反应时间t的关系图与表格中乙容器的反应数据趋势相似,但到达平衡时间比乙长,因此图像为 ,[达到平衡时,x(N2O)=0.07对应的点在120s之后即可];
,[达到平衡时,x(N2O)=0.07对应的点在120s之后即可];
(3)原电池中正极发生还原反应,据图可知该过程中N2O被还原成N2,电解质溶液为稀硫酸,应还生成水,所以电极方程式为N2O+2e-+2H+=N2+H2O。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案